Кислород (O): Химичен елемент, жизненоважен за живот и индустрия
Кислород (O): ролята му в живота, атмосферата и индустрията — от дишане и вода до стомана, медицина и ракети. Открий свойства, формации и ключови приложения.
Кислородът е химичен елемент. Той има символ О и атомен номер 8. Той е третият най-разпространен елемент във Вселената след водорода и хелия.
Кислородът е повече от една пета от обема на земната атмосфера. Във въздуха два кислородни атома обикновено се съединяват, за да образуват диоксиген (O
2) - безцветен газ. Този газ често се нарича просто кислород. Той няма вкус или мирис. Когато е в течно или твърдо състояние, той е бледосин.
Кислородът е част от халкогенната група в периодичната таблица. Той е много реактивен неметал. Той образува оксиди и други съединения с много елементи. Кислородът в тези оксиди и в други съединения (предимно силикатни минерали и калциев карбонат във варовика) съставлява почти половината от земната кора по маса.
Повечето живи същества използват кислород при дишането. Много молекули в живите организми съдържат кислород, като например протеини, нуклеинови киселини, въглехидрати и мазнини. Кислородът е част от водата, от която се нуждае всичко живо, за да живее. Водораслите, цианобактериите и растенията произвеждат газообразния кислород на Земята чрез фотосинтеза. Те използват светлината на Слънцето, за да получат водород от водата, при което се отделя кислород.
В горната част на земната атмосфера се намира озонът (O
3) в озоновия слой. Той поглъща ултравиолетовата радиация, което означава, че до земната повърхност достига по-малко радиация.
Кислородният газ се използва за производство на стомана, пластмаси и текстил. Той има и медицинско приложение и се използва за дишане при липса на добър въздух (например от водолази и пожарникари), както и за заваряване. Течният кислород и богатите на кислород съединения могат да се използват като ракетно гориво.
Физични и химични свойства
Атомни и молекулни характеристики: Атомната маса на кислорода е приблизително 15.999 u. Електронната конфигурация на атома е 1s2 2s2 2p4. Най-разпространената форма в природата е диатомната молекула O
2, която е парамагнитна поради наличието на два неспарени електрона в анти-обвързващите π* орбитали.
Фазови преходи и плътности: Точката на топене на кислорода е около −218.79 °C (54.36 K), а точката на кипене ≈ −182.96 °C (90.19 K). Плътността на газа при стандартни условия е приблизително 1.429 g·L−1, докато течният кислород е бледосин и има висока плътност спрямо газообразната форма.
Химична активност и състояния на окисление: Кислородът е силно реактивен неметал и най-често проявява степен на окисление −2 (въглеродни и метални оксиди). Съществуват и форми като пероксиди (степен −1) и супероксиди (степен −1/2). Той образува оксиди с почти всички елементи и участва в горещи окислителни реакции.
Алотропни форми и изотопи
Алотропи: Основните алотропи са диоксиген (O
2) и озон (O
3). Озонът е силен окислител с характерна миризма и син цвят в концентрирани количества; в стратосферата той играе защитна роля срещу ултравиолетовата радиация, но на земната повърхност е вреден замърсител.
Изотопи: Природният кислород се състои предимно от стабилния изотоп 16O (~99.76%), с малки количества 17O и 18O. радиоактивни изотопи също са известни, но са редки и имат кратки времена на полуразпад.
Разпространение в природата
Кислородът е един от най-разпространените елементи на Земята — съставлява почти половината от масата на земната кора и е основен компонент на вода (H2O), минерали (особено силикатите) и органични съединения. В атмосферата той присъства основно като O
2 (~20.95% по обем).
Биологична роля
Кислородът е незаменим за аеробните организми: той служи като краен акцептор на електрони в клетъчното дишане, което освобождава енергия за метаболитни процеси. Молекули като протеини, нуклеинови киселини, въглехидрати и мазнини съдържат кислород и участват в структурни и енергийни функции. Фотосинтезиращите организми (растения, водорасли, цианобактерии) генерират кислород като страничен продукт на преобразуването на слънчевата енергия във въглехидрати.
Производство и промишлена употреба
- Основен промишлен метод за получаване на кислород е фракционната дестилация на течен въздух, при която се отделят азот, кислород и благородни газове.
- Електролизата на вода произвежда високопurity кислород и е важна в лаборатории и за специфични индустриални приложения.
- Приложения: производство на стомана, химическа индустрия за окислителни процеси, текстил, пластмаси, медицинско използване като терапевтичен кислород, спасителни дейности (водолази, пожарникари), заваряване и използване на течен кислород като ракетно гориво (окислител).
Безопасност и рискове
Поддържане на изгаряне: Кислородът сам по себе си не е запалимо вещество, но значително усилва изгарянето: материали, които не горят добре на въздух, могат да се възпламенят лесно в обогатена с кислород среда.
Кислородна токсичност: При по-високи от атмосферните парциални налягания на кислорода (например при гмуркане или при продължителна употреба на 100% кислород) може да настъпи токсичен ефект върху централната нервна система и белите дробове.
Криогенното съхранение: Течният кислород е екстремно студен и изисква специални съдове; контактът с кожа може да предизвика измръзване. Освен това може да предизвика неочаквани реакции при контакт с органични материали и мазнини.
Кратка историческа бележка
Кислородът е открит независимо през 1770-те години от учените Карл Вилхелм Шееле и Джоузеф Пристли; Антоан Лавоазие обяснява ролята му в горенето и в процесите на окисление и дава името "кислород" (от гръцки: "производител на киселини") — термин, който по-късно се оказва неточен за много вещества, но остава в употреба.
Интересни факти
- Елементът е жизненоважен за повечето висши форми на живот на Земята, но някои организми са анаеробни и живеят без кислород.
- Изотопният състав на кислорода (особено 18O/16O) се използва в климата и палеоклимата за реконструкция на минали температури и климатични условия.
- Кислородът на Земята е следствие от милиарди години фотосинтетична активност и промяната в неговото количество през геоложкото време е свързана с еволюцията на живота и атмосферата.
История
Кислороден газ (O
2) е изолиран от Майкъл Сендивогиус преди 1604 г. Често се смята, че газът е открит през 1773 г. от Карл Вилхелм Шееле в Швеция или през 1774 г. от Джоузеф Пристли в Англия. Обикновено Пристли се смята за главния откривател, тъй като неговият труд е публикуван първи (въпреки че той го нарича "дефлогистичен въздух" и не смята, че това е химичен елемент). През 1777 г. Антоан Лавоазие дава името оксижен на газа. Той е първият човек, който казва, че това е химичен елемент. Освен това е бил прав за това как той помага за протичането на горенето.
Ранни експерименти
Един от първите известни експерименти за това как горенето се нуждае от въздух е проведен от гърка Филон Византийски през II в. пр. В своя труд Pneumatica той пише, че обръщането на съд с главата надолу над горяща свещ и поставянето на вода около този съд означава, че част от водата влиза в съда. Филон смятал, че това се дължи на превръщането на въздуха в класическия елемент огън. Това е погрешно. Дълго време след това Леонардо да Винчи разбрал, че при горенето се изразходва известно количество въздух и това принуждава водата да влезе в съда.
В края на XVII в. Робърт Бойл открива, че за горенето е необходим въздух. Английският химик Джон Мейоу допълва това, като показва, че огънят се нуждае само от част от въздуха. Сега я наричаме кислород (O2 ). Той установил, че при горене на свещ в затворен съд водата се издига, за да замени една четиринадесета от обема на въздуха, преди да угасне. Същото се случило, когато в кутията била поставена жива мишка. От това той изчислил, че кислородът се използва както за дишането, така и за горенето.
Теория за флогистона
Робърт Хук, Оле Борх, Михаил Ломоносов и Пиер Байен правят опити с кислород през XVII и XVIII век. Никой от тях не е смятал, че това е химичен елемент. Вероятно това се е дължало на идеята за теорията за флогистона. Повечето хора са вярвали, че именно той причинява горенето и корозията.
J. Й. Бехер създава тази теория през 1667 г., а Георг Ернст Щал я допълва през 1731 г. Теорията за флогистона гласи, че всички горими материали се състоят от две части. Едната част, наречена флогистон, се отделя при изгарянето на веществото, което я съдържа.
Смята се, че материалите, които оставят много малко остатъци при горене, като дървото или въглищата, са изградени предимно от флогистон. Смятало се е, че нещата, които корозират, като желязото, съдържат много малко количество. Въздухът не е бил част от тази теория.
Откритие
Полският алхимик, философ и лекар Майкъл Сендивогиус пише за нещо във въздуха, което той нарича "храна на живота", и има предвид това, което днес наричаме кислород. Между 1598 г. и 1604 г. Сендивогиус установява, че веществото във въздуха е същото, което той получава при нагряване на калиев нитрат. Някои хора смятат, че това е откриването на кислорода, докато други не са съгласни с това. Някои твърдят, че кислородът е открит от шведския фармацевт Карл Вилхелм Шееле. Той получава кислород през 1771 г., като нагрява живачен оксид и някои нитрати. Шееле нарекъл получения газ "огнен въздух", защото това бил единственият известен газ, който позволявал горене (по това време газовете се наричали "въздух"). Той публикува откритието си през 1777 г.
На 1 август 1774 г. британският духовник Джоузеф Пристли фокусира слънчева светлина върху живачен оксид в стъклена тръба. От този експеримент той получава газ, който нарича "дефлогистичен въздух". Той установил, че свещите горят по-ярко в този газ, а мишките живеят по-дълго, докато го дишат. След като вдишал газа, Пристли казал, че усещането е като за нормален въздух, но след това дробовете му се чувствали по-леки и леки. Откритията му са публикувани през 1775 г. Често се твърди, че той е открил кислорода, защото откритията му са публикувани първи.
По-късно френският химик Антоан Лавоазие заявява, че също е открил това вещество. Пристли го посещава през 1774 г. и му разказва за своя експеримент. През същата година Шееле изпраща писмо до Лавоазие, в което разказва за своето откритие.
Изследванията на Лавоазие
Лавоазие прави първите основни експерименти върху окисляването. Той е първият човек, който обяснява как работи горенето. Използва тези и други експерименти, за да докаже, че теорията за флогистона е погрешна. Опитал се е също да докаже, че веществото, открито от Пристли и Шееле, е химичен елемент.
При един експеримент Лавоазие установява, че теглото не се увеличава, когато калай и въздух се нагряват в затворен съд. Той също така установил, че въздухът нахлува, когато контейнерът се отвори. След това установил, че теглото на оловото се е увеличило със същото количество, с което се е увеличило теглото на нахлулия въздух. Той публикува откритията си през 1777 г. Той пише, че въздухът се състои от два газа. Единият нарекъл "жизнен въздух" (кислород), който е необходим за горенето и дишането. Другият (азот) нарекъл "азот", което на гръцки означава "безжизнен". (Това все още е името на азота в някои езици, включително във френския.)
Лавоазие преименува "жизнения въздух" на "oxygène", от гръцки думи, означаващи "правене на киселини" или "производство на киселина". Нарекъл го е така, защото е смятал, че кислородът се съдържа във всички киселини, което е погрешно. По-късно химиците осъзнават, че наименованието на газа на Лавоазие е погрешно, но дотогава името е твърде разпространено, за да се промени.
"Кислородът" става име в английския език, въпреки че английските учени са против него.
По-късна история
Теорията на Джон Далтън за атомите гласи, че всички елементи имат един атом, а атомите в съединенията обикновено са самостоятелни. Например той погрешно смята, че водата (H2 O) има формула само HO. През 1805 г. Жозеф Луи Гей-Люсак и Александър фон Хумболт показват, че водата е съставена от два водородни и един кислороден атом. През 1811 г. Амедео Авогадро правилно определя от какво се състои водата въз основа на закона на Авогадро.
В края на XIX в. учените откриват, че въздухът може да се превърне в течност, а съединенията в него да се изолират чрез компресиране и охлаждане. Швейцарският химик и физик Раул Пикте открива течния кислород, като изпарява серен диоксид, за да превърне въглеродния диоксид в течност. След това го изпарява, за да охлади газообразния кислород и да го превърне в течност. На 22 декември 1877 г. той изпраща телеграма до Френската академия на науките, в която съобщава за откритието си.

Въздух за разлагане на Лавоазие
Характеристики
Свойства и молекулна структура
При стандартна температура и налягане кислородът няма цвят, мирис или вкус. Той е газ с химична формула O
2 наречен диоксиген.
Като диоксиген (или просто кислороден газ) два кислородни атома са химически свързани един с друг. Тази връзка може да се нарече по много начини, но просто се нарича ковалентна двойна връзка. Газовият кислород е много реактивен и може да реагира с много други елементи. Оксидите се получават, когато метални елементи реагират с кислород, например железен оксид, който е известен като ръжда. На Земята има много оксидни съединения.
Алотропи
Най-разпространеният алотроп (вид) на кислорода на Земята се нарича диоксиген (O2 ). Той е втората по големина част от земната атмосфера след динитрогена (N2 ). Дължината на връзката на O2 е 121 pm, а енергията на връзката - 498 kJ/mol Заради енергията си O2 се използва от сложни организми като животните.
Озонът (O3 ) е много реактивен и уврежда белите дробове, когато се вдишва. Озонът се образува в горните слоеве на атмосферата, когато O2 се комбинира с чист кислород, получен при разцепването на O2 от ултравиолетовата радиация. Озонът поглъща много радиация в ултравиолетовата част на електромагнитния спектър и така озоновият слой в горните слоеве на атмосферата предпазва Земята от радиация.
Над озоновия слой (в ниските орбити на Земята) атомният кислород става най-разпространената форма.
Тетраоксигенът (O4 ) е открит през 2001 г. Той съществува само при екстремни условия, когато върху O2 се оказва голямо налягане.
Физични свойства
Кислородът се разтваря по-лесно от въздуха във водата, отколкото азотът. 2Когато има еднакво количество въздух и вода, на всеки 2 молекули N се пада една молекула O (2съотношение 1:2). Това е различно от въздуха, където съотношението между кислорода и азота е 1:4. Освен това О2 се разтваря по-лесно в сладка вода, отколкото в морска. Кислородът кондензира при 90,20 K (-182,95 °C, -297,31 °F) и замръзва при 54,36 K (-218,79 °C, -361,82 °F). Както течният, така и твърдият O2 са прозрачни със светлосин цвят.
Кислородът е много реактивен и трябва да се пази от всичко, което може да изгори.
Изотопи
В природата има три стабилни изотопа на кислорода. Те са O,1617 O и18 O. Около 99,7% от кислорода е изотопът16 O.
Случайност
Кислородът е третият най-разпространен елемент във Вселената след водорода и хелия. Около 0,9 % от масата на Слънцето е кислород.
| Десетте най-често срещани елемента в галактиката Млечен път, оценени спектроскопски | ||||
| Z | Елемент | Масова фракция в части на милион | ||
| 1 | 739,000 | 71 × масата на кислорода (червена лента) | ||
| 2 | 240,000 | 23 × масата на кислорода (червена лента) | ||
| 8 | Кислород | 10,400 |
| |
| 6 | 4,600 |
| ||
| 10 | Неон | 1,340 |
| |
Освен желязото, кислородът е най-разпространеният елемент на Земята (по маса). Той съставлява почти половината (от 46 % до 49,2 %) от земната кора като част от оксидни съединения като силициев диоксид и други съединения като карбонати. Той е и основната част от земните океани, като съставлява 88,8 % от масата им. Газовият кислород е втората най-разпространена част на атмосферата, като съставлява 20,95 % от нейния обем и 23,1 % от нейния обем. Земята е странна в сравнение с другите планети, тъй като голяма част от нейната атмосфера е кислороден газ. Марс има само 0,1 % O
2 по обем, а на другите планети е по-малко от това количество.
Много по-голямото количество кислороден газ около Земята се дължи на кислородния цикъл. При фотосинтезата водородът се получава от водата, като се използва енергията на слънчевата светлина. При това се отделя кислород. Част от водорода се съединява с въглероден диоксид, за да се получат въглехидрати. След това дишането отнема кислородния газ от атмосферата или водата и го превръща във въглероден диоксид и вода.
Използва
Медицински
O2 е много важна част от дишането. Поради това се използва в медицината. Използва се за увеличаване на количеството кислород в кръвта на човека, за да може да се извършва повече дишане. Това може да доведе до по-бързото им оздравяване, ако са болни. Кислородната терапия се използва за лечение на емфизем, пневмония, някои сърдечни проблеми и всякакви заболявания, които затрудняват приемането на кислород от човека.
Поддръжка на живота
В космическите скафандри се използва O2 с ниско налягане, който обгръща тялото с газ. Използва се и чист кислород, но при много по-ниско налягане. Ако налягането е по-високо, той би бил отровен.
Индустриални
При топенето на желязна руда в стомана се използват около 55% от кислорода, произведен от хората. За тази цел в рудата се вкарва газ O чрез 2копие под високо налягане. По този начин от рудата се отстраняват сярата и въглеродът, които не са желани. Те се отделят под формата на серен оксид и въглероден диоксид. Температурата може да достигне до 1700 °C, тъй като това е екзотермична реакция.
Около 25% от кислорода, произведен от хората, се използва от химиците. Етиленът реагира с O2 , за да се получи етиленов оксид. След това той се превръща в етиленгликол, който се използва за производството на много продукти, като например антифриз и полиестер (от тях могат да се произвеждат пластмаси и тъкани).
Останалите 20 % от кислорода, произведен от хората, се използват в медицината, при рязане и заваряване на метали, за ракетно гориво и за пречистване на вода.

Кислороден концентратор в дома на пациент с емфизем
Съединения
Състоянието на окисление на кислорода е -2 в почти всяко съединение, в което се намира. В няколко съединения окислителното състояние е -1, например в пероксидите. Съединенията на кислорода с други кислородни състояния са много рядко срещани.
Оксиди и други неорганични съединения
Вода (H
2O) е оксид на водорода. Той е най-разпространеният оксид на Земята. Всички познати живи организми се нуждаят от вода, за да живеят. Водата се състои от два водородни атома, ковалентно свързани с кислороден атом (кислородът има по-висока електроотрицателност от водорода). (това е основният принцип на ковалентната връзка) Между водородните атоми и кислородните атоми на съседните молекули съществуват и електростатични сили (сили на Ван де'р Ваалс). Тези псевдовръзки приближават атомите с около 15 % един до друг в сравнение с повечето други прости течности. Това се дължи на факта, че водата е полярна молекула (Нетно асиметрично разпределение на електроните) поради огънатата си форма, което ѝ придава обща нетна посока на полето, главно поради 2 несвързващи се двойки електрони на оксигена, избутващи свързващите се Н по-далеч един от друг, отколкото линейното разположение с по-ниска енталпия (вж. CO2 ). Това свойство се използва от микровълните за осцилиране на полярните молекули, особено на водата. То е отговорно за допълнителната енергия, необходима за дисоциацията на H 0. 2
Поради високата електроотрицателност на кислорода той създава химични връзки с почти всички други химични елементи. Тези връзки водят до образуване на оксиди (например желязото реагира с кислород, като се получава железен оксид). Повърхностите на повечето метали се превръщат в оксиди, когато са на въздух. Повърхността на желязото се превръща в ръжда (железен оксид), когато е дълго време на въздух. В атмосферата има малки количества въглероден диоксид (CO
2) във въздуха и той се превръща във въглехидрати по време на фотосинтезата. Живите същества го отделят при дишането.
Органични съединения
В много органични съединения има кислород. Някои от класовете органични съединения, които съдържат кислород, са алкохоли, етери, кетони, алдехиди, карбоксилни киселини, естери и амиди. Много органични разтворители също съдържат кислород, като ацетон, метанол и изопропанол. Кислородът се съдържа и в почти всички биомолекули, които се произвеждат от живите същества.
Кислородът също така реагира бързо с много органични съединения при стайна температура или под нея, когато се извършва автоокисление.
Промишлено производство
Сто милиона тона O2 се получават от въздуха за промишлени цели всяка година. Индустрията използва два основни метода за производство на кислород. Най-разпространеният метод е фракционната дестилация на втечнен въздух. N 2се изпарява, а O2 остава като течност. O2 е вторият по важност промишлен газ. тъй като е по-икономичен , кислородът обикновено се съхранява и транспортира като течност. Малък стоманен резервоар с вместимост 16 литра вода и работно налягане 139 бара (2015 psi) побира около 2150 литра газ и празен тежи 28 килограма (62 lb). 2150 литра кислород тежат около 3 килограма (6,6 фунта).
Другият основен метод за производство на кислород е чрез преминаване на поток чист, сух въздух през двойка молекулярни сита от зеолит. Молекулярните сита на зеолита поглъщат азота. Така се получава поток от газ, който съдържа 90-93 % кислород.
Кислороден газ може да се получи и чрез електролиза на вода на молекулярен кислород и водород.

Цилиндърът вдясно съдържа течен кислород.
Безопасност
В NFPA 704 за кислорода се казва, че сгъстеният кислороден газ не е опасен за здравето и не е запалим.
Токсичност
При високо налягане газовият кислород (O2 ) може да бъде опасен за животните, включително и за хората. Той може да предизвика конвулсии и други здравословни проблеми. Кислородната токсичност обикновено започва да се проявява при налягане над 50 килопаскала (kPa), което се равнява на около 50 % кислород във въздуха при стандартно налягане (въздухът на Земята има около 20 % кислород).
Преди време недоносените бебета са били поставяни в кутии с въздух с високо съдържание на O2 . Това е било преустановено, когато някои бебета са ослепели от кислорода.
Дишането на чист О2 в космическите скафандри не причинява увреждания, тъй като се използва по-ниско налягане.
Горивни и други опасности
Концентрираните количества чист O2 могат да предизвикат бърз пожар. Когато концентрираният кислород и горивата са близо едно до друго, леко запалване може да предизвика огромен пожар. Всички членове на екипажа на "Аполо 1" са загинали от пожар, защото въздухът в капсулата е съдържал много голямо количество кислород.
Ако течен кислород се разлее върху органични съединения, например дърво, той може да се взриви.
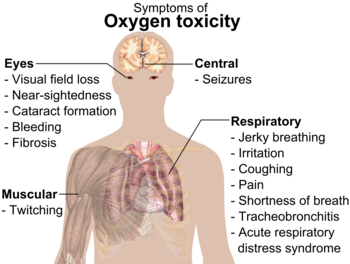
Симптомите на кислородно отравяне.
Свързани страници
Въпроси и отговори
В: Какъв е символът за кислород?
О: Символът на кислорода е О.
В: Колко атома кислород обикновено се съдържат в диоксигена (О2)?
О: Обикновено диоксигенът (О2) съдържа два атома кислород.
В: Какъв цвят е течният или твърдият кислород?
О: Течният или твърдият кислород е бледосин на цвят.
В: Към коя група на периодичната таблица принадлежи кислородът?
О: Кислородът принадлежи към халкогенната група в периодичната таблица.
В: Каква част от земната атмосфера по обем се състои от кислород?
О: Кислородът съставлява повече от една пета от земната атмосфера по обем.
В: Как растенията и другите организми произвеждат по-голямата част от атмосферния кислород на Земята?
О: Растенията и другите организми произвеждат по-голямата част от атмосферния кислород на Земята чрез фотосинтеза, при която слънчевата светлина се използва за превръщане на водата във водород и се отделя кислород като страничен продукт.
В: Какви приложения има течната или втвърдената форма на кислорода?
О: Течните или втвърдени форми на кислорода могат да се използват като ракетни горива, за заваряване, за медицински цели и за дишане, когато няма добър въздух (напр. водолази и пожарникари).
обискирам