Какво е атом: дефиниция, строеж, изотопи и свойства
Научете какво е атом: дефиниция, строеж, изотопи и свойства — ясни обяснения за протони, неутрони, електрони, йони, размери и примери като вода и злато.
Атомът е най-основната единица на материята. Цялата нормална материя на Земята и навсякъде във Вселената е изградена от атоми. Това включва твърди вещества, течности и газове. Съществуват определен брой различни видове атоми, наречени химични елементи. Атомът е най-малката единица материя, която може да се комбинира с други атоми, за да образува молекули и по-сложни вещества, които имат специфични химични качества.
Размер и наблюдение
Атомите са много малки, но точният им размер зависи от вида им. Атомите са с диаметър от 0,1 до 0,5 нанометра. Един нанометър е около 100 000 пъти по-малък от ширината на човешки косъм. Това прави невъзможно да се види един атом с просто око; за наблюдение се използват специални инструменти като сканиращ тунелен микроскоп (STM) и атомно-силов микроскоп (AFM), електронна микроскопия (TEM) и различни спектроскопски методи. Учените изследват как работят атомите, като правят експерименти и чрез теоретични модели.
Структура на атома
Атомите се състоят от три вида субатомни частици: протони, неутрони и електрони. Протоните и неутроните са по-тежки и се намират в средата на атома, която се нарича ядро. Ядрото е много малко и плътно. То е заобиколено от леки електрони. Електроните се привличат към ядрото чрез електромагнитната сила, тъй като имат противоположни електрически заряди.
Няколко важни понятия:
- Атомен номер (Z): равен е на броя протони в ядрото и определя кое е химичното елемент.
- Масово число (A): сумата от протоните и неутроните в ядрото. Често се дава като приблизителна атомна маса в атомни масови единици (u).
- Електронна конфигурация: подреждането на електроните в енергийни нива (слоеве) и орбитали, което определя химичните свойства на атома.
- Ион: ако атомът има повече или по-малко електрони в сравнение с протоните, той носи нетен заряд и се нарича йон.
Модели на атома
През историята са предложени различни модели на атома. Класическият Бор модел обяснява някои спектрални линии, но съвременната теория използва квантовомеханичния модел, в който електроните са описани чрез вероятностни облаци (орбитали). Този модел обяснява защо електроните запълват определени енергийни нива и защо атомите формират определени видове химични връзки.
Изотопи и радиоактивност
Атомите с еднакъв брой протони са един и същ химичен елемент и имат много сходни свойства. Примери за елементи са водородът и златото. В природата се срещат около 92 стабилни елемента; повече са създадени изкуствено в лаборатория. Атомите с еднакъв брой протони, но с различен брой неутрони, се наричат изотопи. Някои изотопи са стабилни, други — нестабилни (радиоактивни) и се разграждат чрез алфа, бета или гама разпад, или чрез спонтанно делене.
Примери:
- Водородът има изотопи протий (1H), дейтерий (2H) и тритий (3H).
- Уранът има важни изотопи 235U и 238U; 235U е ключов за ядрено делене.
Химични свойства и връзки
Атомите рядко съществуват самостоятелно в природата; повечето вещества са изградени от множество атоми, свързани в химични съединения или смеси. Атомите могат да се свързват чрез различни видове химични връзки:
- Ковалентна връзка: споделяне на електрони между атоми (напр. водата — H2O).
- Йонна връзка: електростатично привличане между заредени йони (напр. натриев хлорид).
- Метална връзка: делокализирани електрони в метали, които позволяват проводимост и пластичност.
- Взаимодействия слаби като Ван дер Ваалс и водородни връзки: важни за структурата на биомолекулите и свойствата на течностите.
Група от атоми, свързани с химични връзки, се нарича молекула. Например молекулата на водата е съставена от два водородни атома и един кислороден атом.
Ядрени процеси и образуване на елементи
Атомите рядко се създават, унищожават или превръщат в друг вид атом при нормални химични процеси. Когато това се случва, то е в резултат на ядрени процеси и се изучава в ядрената физика. Ядрени реакции могат да променят броя на протоните в ядрото, като по този начин трансформират елементите — например при радиоактивен разпад или при ядрено делене и сливане.
Атомите могат също така да се съединяват, за да образуват по-големи атоми при много високи температури и налягания, например във вътрешността на звезда (нуклеосинтеза). Звездите чрез термоядрени реакции синтезират по-тежки елементи от водорода и хелия.
Физични свойства и измервания
Атомните маси се измерват в атомни масови единици (u), където 1 u приблизително е масата на един протон или неутрон (≈1.66×10^-27 kg). Масата на електрона е значително по-малка (≈9.11×10^-31 kg). Други важни величини са радиусът на атома, енергията на йонизация (колко енергия е нужна за отстраняване на електрон) и електронегативността (склонността на атом да привлича електрони в химична връзка).
Защо атомите са важни
Атомите са основата на всичко във физическия свят — от биологичните молекули в живите организми до материалите, които използваме всеки ден. Разбирането на тяхната структура и взаимодействия позволява да се развиват нови материали, лекарства, енергийни технологии и много други приложения.
Кратко обобщение: атомът е съставен от ядро (протони и неутрони) и електронна обвивка; атомният номер определя елемента; изотопите са варианти с различен брой неутрони; химичните свойства зависят от електронната конфигурация; ядрени процеси могат да променят самия елемент.
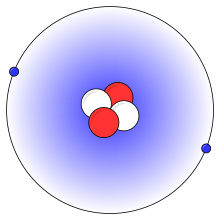
Опростена картина на хелиев атом с два протона (червено), два неутрона (бяло) и два електрона (синьо).
История
Думата "атом" идва от гръцкото (ἀτόμος) "atomos", неделим, от (ἀ)-, не, и τόμος, разрез. Първият човек, за когото знаем, че е използвал думата "атом", е гръцкият философ Демокрит, около 400 г. пр. Хр. той е вярвал, че всичко е съставено от атоми и че атомите не могат да бъдат разбити на по-малки части. Първоначално атомната теория е била философска тема, без много реални научни изследвания или проучвания, до развитието на химията през 50-те години на XIX век.
През 1777 г. френският химик Антоан Лавоазие за първи път дефинира понятието "елемент". Според него елемент е всяко основно вещество, което не може да бъде разградено на други вещества чрез методите на химията. Всяко вещество, което може да бъде разградено, е съединение.
През 1803 г. английският философ Джон Далтън изказва предположението, че елементите се състоят от малки твърди топчета, наречени атоми. Далтън смята, че всички атоми на един и същ елемент имат еднаква маса. Той твърди, че съединенията се образуват, когато атомите на повече от един елемент се комбинират. Според Далтън в дадено съединение атомите на елементите на съединението винаги се комбинират по един и същи начин.
През 1827 г. британският учен Робърт Браун разглежда под микроскоп поленови зърна във вода. Изглежда, че поленовите зърна се движат. Браун използва атомната теория на Далтън, за да опише закономерностите в движението им. Това се нарича Брауново движение. През 1905 г. Алберт Айнщайн използва математиката, за да докаже, че поленовите частици се движат от движението или топлината на отделните водни молекули. По този начин той окончателно доказва съществуването на атома. През 1869 г. руският учен Дмитрий Менделеев публикува първата версия на периодичната таблица. Периодичната таблица групира елементите по техния атомен номер (колко протона имат; обикновено той съвпада с броя на електроните). Елементите в една и съща колона или период обикновено имат сходни свойства. Например хелий, неон, аргон, криптон и ксенон са в една и съща колона и имат много сходни свойства. Всички тези елементи са газове, които нямат цвят или мирис. Също така те не могат да се комбинират с други атоми, за да образуват съединения. Заедно те са известни като благородни газове.
Физикът Джей Джей Томсън е първият, който открива електроните. Това се случва през 1897 г., когато той работи с катодни лъчи. Той разбира, че те имат отрицателен заряд, а атомното ядро - положителен. Томсън създава модела на пудинга, според който атомът е като пудинг от сливи: сушените плодове (електроните) са заклещени в маса от пудинг (с положителен заряд). През 1909 г. учен на име Ърнест Ръдърфорд използва експеримента на Гайгер-Марсден, за да докаже, че по-голямата част от атома се намира в много малко пространство - атомното ядро. Ръдърфорд взел фотографска плака и я покрил със златно фолио. След това изстрелва към нея алфа частици (съставени от два протона и два неутрона, залепени един за друг). Много от частиците преминаха през златното фолио, което доказа, че атомите са предимно празно пространство. Електроните са толкова малки и бързо движещи се, че не пречат на частиците да преминат през него. По-късно Ръдърфорд открива протоните в ядрото.
През 1913 г. Нилс Бор въвежда модела на Бор. Този модел показва, че електроните се движат около ядрото по фиксирани кръгови орбити. Той е по-точен от модела на Ръдърфорд. Въпреки това той все още не е напълно верен. След първото въвеждане на модела на Бор са направени подобрения в него.
През 1925 г. химикът Фредерик Соди открива, че някои елементи в периодичната таблица имат повече от един вид атом, наречени изотопи. Соди смята, че изотопите на даден елемент имат различна маса. За да докаже това, химикът Франсис У. Астън построява масспектрометър, който измерва масата на отделните атоми. Астън доказва, че Соди е бил прав. Той също така установил, че масата на всеки атом е цяло число, умножено по масата на протона. Това означавало, че в ядрото трябва да има и друга частица освен протоните. През 1932 г. физикът Джеймс Чадуик изстрелва алфачастици в атоми на берилий. Той видял, че от атомите на берилия се изстрелва частица. Тази частица нямала заряд, но имала приблизително същата маса като протона. Той нарича тази частица неутрон.
Най-точният модел досега се основава на уравнението на Шрьодингер. Шрьодингер научава, че електроните съществуват в облак около ядрото, наречен електронен облак. В електронния облак е невъзможно да се знае къде точно се намират електроните. Уравнението на Шрьодингер се използва, за да се определи къде е вероятно да се намира електрон. Тази област се нарича орбита на електрона.
През 1937 г. германският химик Ото Хан става първият човек, който осъществява ядрено делене в лаборатория. Той открива това случайно, когато изстрелва неутрони към уранов атом с надеждата да получи нов изотоп. Той обаче забелязал, че вместо нов изотоп, уранът се е превърнал в атом барий, по-малък от урана. Хан е "счупил" атома на урана. Това е първата в света регистрирана реакция на ядрено делене. Това откритие в крайна сметка води до създаването на атомната бомба и ядрената енергия, при която деленето се извършва многократно, създавайки верижна реакция.
През 20-и век физиците се задълбочават в тайните на атома. С помощта на ускорители на частици те откриват, че протоните и неутроните са изградени от други частици, наречени кварки.
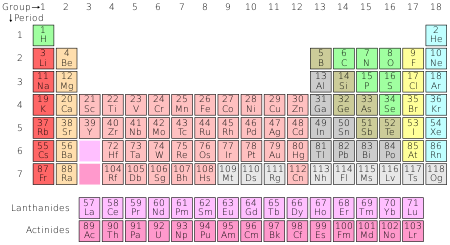
Периодичната таблица подрежда всички известни химични елементи.

Ърнест Ръдърфорд
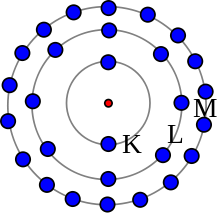
Моделът на Бор не е точен, но е полезен за идеята за електронните обвивки. Този атом има 28 електрона в три обвивки.
Класификация
Броят на протоните в един атом се нарича негов атомен номер. Атомите на един и същ елемент имат един и същ атомен номер. Например всички въглеродни атоми имат шест протона, така че атомният номер на въглерода е шест. Днес са известни 118 елемента. В зависимост от начина на отчитане, на Земята естествено съществуват от 90 до 94 елемента. Всички елементи над номер 94 са създадени само от хората. Тези елементи са подредени в периодичната таблица.
Тъй като масата на протоните и неутроните е много сходна, а масата на електроните е много малка, можем да наречем броя на протоните и неутроните в един атом масово число. Повечето елементи имат няколко изотопа с различни масови числа. За да назовем даден изотоп, използваме името на елемента, последвано от масовия му номер. Така атом с шест протона и седем неутрона се нарича въглерод-13. Средната маса на всички атоми на даден елемент се нарича негова атомна маса или атомно тегло.
Ако протоните, неутроните или електроните на даден атом се заменят с други частици, могат да се получат екзотични атоми. Експериментите показват, че всяка частица има своя противоположност, наречена античастица. Заедно тези частици съставляват антиматерията. Атомът на антиматерията би бил съставен от антипротони, антинеутрони и антиелектрони (позитрони). Когато една частица срещне своята античастица, и двете се разрушават. Освен това атомите на антиматерия могат да бъдат много подобни на нормалните атоми.
Структура и части
Части
Атомът е съставен от три основни частици: протон, неутрон и електрон. Водород-1, изотоп на водорода, няма неутрони, а само един протон и един електрон. Положителният водороден йон няма електрони, а само един протон. Всички останали атоми имат поне по един протон, един неутрон и един електрон.
Електроните са най-малките от трите атомни частици. Размерът им е твърде малък, за да бъде измерен с помощта на сегашните технологии, а масата им е около 9,1×10−28 грама (0,00055 атомни масови единици). Те имат отрицателен заряд. Протоните и неутроните са със сходни размери и тегло помежду си, като масата им е около 1,7×10−24 грама (1 атомна единица маса). Протоните имат положителен заряд, а неутроните нямат заряд. Повечето атоми имат неутрален заряд. Броят на протоните (положителни) и електроните (отрицателни) е еднакъв, така че зарядите се балансират до нула. При йоните обаче (различен брой електрони) това не е така и те могат да имат положителен или отрицателен заряд. Протоните и неутроните се състоят от два вида кварки: възходящи и низходящи кварки. Протонът е съставен от два възходящи кварка и един низходящ кварк, а неутронът - от два низходящи кварка и един възходящ кварк.
Ядро
Ядрото се намира в средата на атома. То съставлява повече от 99,9 % от масата на атома. Въпреки това то е много малко: с диаметър около 1 фемтометър (10−15 m), което е около 100 000 пъти по-малко от ширината на атома, така че има много висока плътност. Той е съставен от протони и неутрони. Обикновено в природата две неща с еднакъв заряд се отблъскват или се изстрелват едно от друго. Затова дълго време учените не знаеха как положително заредените протони в ядрото се задържат заедно. Сега смятаме, че привличането между протоните и неутроните идва от силното взаимодействие.
Силното взаимодействие е най-силно на много кратко разстояние. На това разстояние то се пренася от частица, наречена глуон. Глюоните действат като лепило, за да залепят кварките заедно в протона или неутрона. На по-голямо разстояние силното взаимодействие е по-слабо. То се пренася от частица, наречена мезон. Мезоните привличат протоните и неутроните, използвайки силното взаимодействие. Те държат ядрото заедно. Тази специална форма на силното взаимодействие се нарича ядрена сила.
Броят на неутроните спрямо протоните определя дали ядрото е стабилно, или преминава през радиоактивен разпад. Когато има твърде много неутрони или протони, атомът се опитва да направи броя им по-малък или по-равномерен, като отстранява допълнителните частици. Той прави това, като излъчва радиация под формата на алфа, бета или гама разпад. Ядрата могат да се променят и по други начини. Ядреното делене е, когато ядрото се разпада на две по-малки ядра, при което се освобождава много енергия. Това освобождаване на енергия прави ядреното делене полезно за производството на бомби и на електричество под формата на ядрена енергия. Другият начин, по който ядрата могат да се променят, е чрез ядрен синтез, когато две ядра се съединяват или сливат, за да се получи по-голямо ядро. Този процес изисква изключително много енергия, за да се преодолее електростатичното отблъскване между протоните, тъй като те имат еднакъв заряд. Такива високи енергии се срещат най-често в звезди като нашето Слънце, което слива водород за гориво. След като термоядреният синтез се осъществи обаче, се освобождава много повече енергия поради превръщането на част от масата в енергия.
Електрони
Електроните обикалят или се движат около ядрото. Те се наричат електронен облак на атома. Те се привличат към ядрото благодарение на електромагнитната сила. Електроните имат отрицателен заряд, а ядрото винаги има положителен заряд, затова те се привличат взаимно.
Според модела на Бор някои електрони се намират по-далеч от ядрото, отколкото други в различните слоеве. Те се наричат електронни обвивки. Научихме, че само електроните във външната обвивка могат да правят химични връзки. Броят на електроните във външната обвивка определя дали атомът е стабилен или с кои атоми ще се свърже при химична реакция. Ако атомът има само една обвивка, той се нуждае от два електрона, за да бъде пълен. В противен случай външната обвивка се нуждае от осем електрона, за да бъде пълна.
Моделът на Бор е важен, защото съдържа идеята за енергийните нива. Електроните във всяка обвивка имат определено количество енергия. Обвивките, които са по-далеч от ядрото, имат повече енергия. Когато малък изблик на енергия, наречен фотон, попадне върху електрон, електронът може да премине в обвивка с по-висока енергия. Този фотон трябва да носи точното количество енергия, за да пренесе електрона на новото енергийно ниво. Фотонът е изблик на светлина, а количеството енергия определя цвета на светлината. Така че всеки вид атом ще поглъща определени цветове светлина, наречени спектър на поглъщане. Електронът може също така да изпрати или излъчи фотон и да попадне в по-ниска енергийна обвивка. По подобни причини атомът ще изпраща само определени цветове светлина, наречени спектър на излъчване.
Цялостната картина е по-сложна. За разлика от Земята, която се движи около Слънцето, електроните не се движат в кръг. Не можем да знаем точното място на електрона. Знаем само вероятността, или шанса, той да се намира на някое място. Всеки електрон е част от орбита, която описва мястото, където има вероятност да се намира. В една орбитала могат да се намират не повече от два електрона; тези два електрона имат различен спин.
За всяка обвивка с номера 1, 2, 3 и т.н. може да има няколко орбитали с различна форма. Видовете орбитали са дадени с букви: s, p, d и f. За една комбинация от номер и буква може да има и няколко орбитали. Когато се добавят повече електрони, те се присъединяват към орбитали в реда от най-ниска към най-висока енергия. Този ред започва по следния начин: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d. Например атомът на хлора има 17 електрона. Така че той ще има 2 електрона в орбитала 1s, 2 електрона в орбитала 2s, 6 електрона в орбитала 2p, 2 електрона в орбитала 3s и 5 електрона в орбитала 3p. С други думи, той има 2 електрона в първата обвивка, 8 във втората обвивка и 7 в третата обвивка.
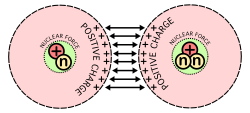
Снимка, показваща основните трудности при ядрения синтез: Протоните, които имат положителен заряд, се отблъскват един от друг, когато са принудени да се съберат.

Форми на различните орбитали около атома
Свойства
Размер и маса
Размерът на атома зависи от размера на електронния му облак. Придвижвайки се надолу по периодичната таблица, се добавят все повече електронни обвивки. В резултат на това атомите стават по-големи. Придвижвайки се надясно в периодичната таблица, към ядрото се добавят повече протони. Въпреки това не се добавят електронни обвивки. Това по-положително ядро привлича по-силно електроните, поради което атомите стават по-малки. Най-големият атом е цезият, който според един модел е широк около 0,596 нанометра. Най-малкият атом е хелий, който е широк около 0,062 нанометра.
Масата на атомите е от 1,7×10−24 до 4,9×10 −22грама. Обикновено масата се измерва с помощта на единицата за атомна маса (amu), наричана още далтон. Един аму е точно 1/12 от масата на атома на въглерод-12, която е 1,7×10−24 грама. Масата на водород-1 е около 1 аму, а най-тежкият известен атом - оганесонът, е с маса около 294 аму.
Как си взаимодействат атомите
Когато атомите са далеч един от друг, те се привличат. Това привличане е по-силно за някои видове атоми, отколкото за други. В същото време топлината или кинетичната енергия на атомите ги кара да се движат постоянно. Ако привличането е достатъчно силно в сравнение с количеството топлина, атомите образуват твърдо тяло. Ако привличането е по-слабо, те ще образуват течност, а ако е още по-слабо, ще образуват газ.
Химичните връзки са най-силните видове привличане между атомите. Всички химични връзки включват движение на електрони. Атомите обикновено се свързват помежду си по начин, който запълва или изпразва външната им електронна обвивка. Най-реактивните елементи трябва да загубят или спечелят малък брой електрони, за да имат пълна външна обвивка. Атомите с пълна външна обвивка, наречени благородни газове, обикновено не образуват връзки.
Съществуват три основни вида връзки: йонни, ковалентни и метални.
- При йонната връзка един атом предава електрони на друг атом. Всеки атом се превръща в йон: атом или група атоми с положителен или отрицателен заряд. Положителният йон (който е изгубил електроните си) се нарича катион; той обикновено е метал. Отрицателният йон (който е спечелил електрони) се нарича анион; той обикновено е неметал. Йонната връзка обикновено води до образуване на решетка или кристал от йони, които са свързани помежду си.
- При ковалентната връзка два атома си поделят електроните. Това обикновено се случва, когато и двата атома са неметали. Ковалентните връзки често образуват молекули с размери от два до много повече атома. Те могат да образуват и големи мрежи, като например стъкло или графит. Броят на връзките, които прави един атом (неговата валентност), обикновено е броят на електроните, необходими за запълване на външната му електронна обвивка.
- В металната връзка електроните се движат свободно между много метални атоми. Всеки брой атоми може да се свърже по този начин. Металите провеждат електрически ток, защото през тях лесно преминава електрически заряд. Атомите в металите могат да се движат един покрай друг, така че е лесно да се огъват, разтягат и променят формата на металите.
Всички атоми се привличат помежду си чрез силите на Ван дер Ваалс, които са по-слаби от химичните връзки. Тези сили се предизвикват, когато електроните се придвижват към едната страна на атома. Това движение дава отрицателен заряд на тази страна. То дава положителен заряд и на другата страна. Когато два атома подредят страните си с отрицателен и положителен заряд, те ще се привличат.
Въпреки че е предимно празно пространство, атомите не могат да преминават един през друг. Когато два атома са много близо, електронните им облаци се отблъскват един от друг чрез електромагнитната сила.
Магнетизъм
Електронът има свойство, наречено магнитен момент, което има посока и големина (или размер). Магнитният момент се дължи на индивидуалния спин на електрона и орбитата му около ядрото. Заедно магнитните моменти на електроните се събират в един магнитен момент за целия атом. Това обяснява поведението на атомите в магнитно поле.
Всеки електрон в атома има един от двата вида спин. Ако всеки електрон се сдвои с електрон с противоположен спин, спиновете ще се неутрализират, така че атомът няма да има траен магнитен момент. Такива атоми се наричат диамагнитни: те се отблъскват слабо от магнитно поле.
Ако обаче някои електрони не са сдвоени, атомът ще има траен магнитен момент: той ще бъде парамагнитен или феромагнитен. Когато атомите са парамагнитни, магнитният момент на всеки атом е насочен в произволна посока. Те са слабо привлечени от магнитно поле. Когато атомите са феромагнитни, магнитните моменти на близките атоми действат един на друг. Те са насочени в една и съща посока. В магнитно поле повечето атоми се подреждат по посока на полето. Феромагнитните материали, като желязо, кобалт и никел, са силно привлечени от магнитно поле.
Радиоактивно разпадане
Някои елементи и много изотопи имат така нареченото нестабилно ядро. Това означава, че ядрото е твърде голямо, за да се задържи заедно, или има твърде много протони или неутрони. Когато това се случи, ядрото трябва да премахне излишната маса от частици. То прави това чрез излъчване. Атом, който прави това, може да се нарече радиоактивен. Нестабилните атоми излъчват радиация, докато не загубят достатъчно частици в ядрото, за да станат стабилни. Всички атоми с атомен номер над 82 (82 протона, олово) са радиоактивни.
Съществуват три основни вида радиоактивно разпадане: алфа, бета и гама.
- Алфа-разпадът е, когато атомът изстрелва частица с два протона и два неутрона. По същество това е хелиево ядро. Резултатът е елемент с атомен номер с два по-малко от предишния. Така например, ако атом на берилий (с атомен номер 4) премине през алфа разпад, той ще се превърне в хелий (с атомен номер 2). Алфа разпадът се случва, когато атомът е твърде голям и трябва да се освободи от част от масата си.
- Бета-разпадът е, когато неутрон се превръща в протон или протон се превръща в неутрон. В първия случай атомът изстрелва електрон. Във втория случай това е позитрон (като електрона, но с положителен заряд). Резултатът е елемент с един по-голям или един по-малък атомен номер от предишния. Бета-разпадът се случва, когато атомът има или твърде много протони, или твърде много неутрони.
- Гама разпадът е, когато атомът изстрелва гама лъчи или вълни. Това се случва, когато има промяна в енергията на ядрото. Обикновено това се случва, след като ядрото е преминало през алфа или бета разпад. Няма промяна в масата на атома или в атомния му номер, а само в натрупаната в ядрото енергия под формата на спин на частиците.
Всеки радиоактивен елемент или изотоп има период на полуразпад. Това е времето, за което половината от всяка проба от атоми от този тип се разпада, докато се превърне в друг изотоп или елемент.
Деление и синтез
Устройствата, които използват ядрено делене, започват с изстрелване на неутрони към атоми. Това кара атома да се разпадне бързо. Разделянето на един атом изстрелва още неутрони, които след това разкъсват други атоми, създавайки верижни реакции. При този процес се получават огромни количества топлинна енергия. Верижната реакция на делене задвижва първите ядрени оръжия (бомбите с деление). Ядрените електроцентрали са малко по-различни: за забавяне на деленето се използват неща, наречени контролни пръти. Контролните пръти събират част от неутроните, което спира верижната реакция.
Ядреният синтез се наблюдава най-вече в Слънцето и други звезди. За него е необходимо горещо място, но при него се получава дори повече енергия, отколкото при деленето. Това обяснява топлината и светлината на Слънцето. Сега Слънцето слива водород в хелий, докато по-големите и горещи звезди правят по-тежки атоми. Термоядрените бомби или термоядрените оръжия са най-мощните ядрени оръжия. Учените се опитват да направят термоядрени реактори за ядрени електроцентрали, но все още не съществува такъв.
Ядреният синтез и ядреното делене произвеждат енергия по сходни причини. Според известната формула на Айнщайн E = mc2 , малко количество маса може да се превърне в голямо количество енергия. Когато протоните и неутроните се съединяват при ядрен синтез, те губят част от масата си, която изпращат като енергия. Ядрото може да се раздели на своите протони и неутрони само ако се добави същото количество енергия. Това свойство на всеки вид ядро се нарича негова ядрена свързваща енергия. При синтез или делене се изпраща енергия, ако общата енергия на свързване се увеличава. Ядрата в диапазона на желязо-56 и никел-62 имат най-висока енергия на свързване, разделена на броя на техните протони и неутрони, така че те обикновено не преминават през делене или синтез. По-големите атоми, като например урана, преминават през ядрено делене, тъй като то увеличава енергията им на свързване.
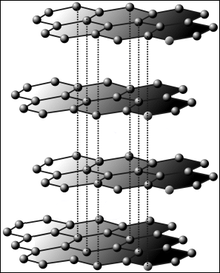
Графитът е съставен от въглеродни атоми, разположени на слоеве. Всеки слой е свързан с ковалентни връзки. Привличането между различните слоеве е силата на Ван дер Ваалс.
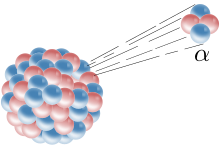
Алфа-частица се изстрелва от ядрото.
Образуване и поява
Почти всички водородни атоми във Вселената, повечето хелиеви атоми и част от литиевите атоми са създадени скоро след Големия взрив. Дори днес около 90 % от всички атоми във Вселената са водородни. По-големите атоми се получават в звездите чрез ядрен синтез, а най-големите атоми се получават в много масивни звезди или свръхнови. Повечето атоми на Земята са направени от звезда, която е съществувала преди Слънцето.
Хората правят много големи атоми, като разбиват по-малки атоми в ускорители на частици. Тези атоми обаче често се разпадат много бързо. Оганесонът (елемент 118) има период на полуразпад от 0,89 милисекунди. Възможно е в бъдеще да бъдат създадени още по-големи атоми.
Свързани страници
- Атомна физика, за повече подробности относно физиката на атомите
- Химия - област, която изучава всички неща, изградени от атоми.
- Елементарни частици, частиците, които изграждат атомите и всичко останало.
- Квантова механика - изучаване на малките частици и тяхното взаимодействие с енергията
- Състояния на материята - различните форми, в които се намират атомите или молекулите
Въпроси и отговори
В: Какво представлява атомът?
О: Атомът е най-основната единица на материята. Той е най-малката единица на материята, която може да се комбинира с други атоми, за да образува молекули и по-сложни вещества, които имат специфични химични качества.
В: Колко големи са атомите?
О: Атомите са много малки, с диаметър от 0,1 до 0,5 нанометра, което е около 100 000 пъти по-малко от ширината на човешки косъм.
В: Кои са трите вида субатомни частици, които изграждат един атом?
О: Трите вида субатомни частици, от които се състои атомът, са протони, неутрони и електрони. Протоните и неутроните са по-тежки и се намират в ядрото, докато електроните са по-леки и се привличат към ядрото с електромагнитна сила поради противоположните си електрически заряди.
Въпрос: Колко елемента се срещат естествено в света?
О: Около 92 елемента се срещат естествено в света.
Въпрос: Какво се случва, когато един атом има повече или по-малко електрони, отколкото протони?
О: Ако атомът има повече или по-малко електрони от протоните, той се нарича йон и има електричен заряд.
В: Какви промени се случват, ако силите в атомите станат твърде слаби, за да ги задържат заедно?
О: Ако силите вътре в атомите станат твърде слаби, за да ги задържат заедно, те могат да се превърнат в друг вид атом или да бъдат напълно унищожени; този процес се изучава от ядрената физика.
обискирам