Молекула: какво е, строеж, видове и примери с молекулни формули
Молекула: ясно обяснение на строежа, видове и примери с молекулни формули (напр. C6H12O6) — разбираемо, с илюстрации и практични примери за ученици и студенти.
Молекулата е най-малкото количество от дадено химично вещество, което може да съществува. Ако една молекула бъде разделена на по-малки части, тя ще бъде различно вещество.
Молекулите се състоят от атоми, които са слепени в определена форма. Не всички комбинации от атоми са еднакво възможни; атомите правят определени форми с предимство пред други. Също така те имат различна валентност. Например кислородните атоми винаги имат две връзки с други атоми, въглеродните атоми винаги имат четири връзки с други атоми, а азотните атоми винаги имат три връзки с други атоми.
В кинетичната теория на газовете терминът "молекула" често се използва за всяка газова частица, независимо от нейния състав. Според това определение атомите на благородните газове се смятат за молекули, тъй като те всъщност са едноатомни молекули.
В газове като въздуха молекулите просто се носят наоколо. В течностите, като водата, молекулите са залепени една за друга, но все пак могат да се движат. В твърдите вещества като захарта молекулите могат само да вибрират. В четвъртото състояние на материята, известно като плазма, атомите са йонизирани и не могат да образуват молекули.
С помощта на молекулна формула можете да запишете номерата на всички атоми в молекулата. Например молекулната формула на глюкозата е C6H12O6. Това означава, че една молекула глюкоза е съставена от шест въглеродни атома, дванадесет водородни атома и шест кислородни атома.
Какво още е важно да знаете за молекулите
Молекулите са носители на химичните свойства на веществата. Характерът и разпределението на връзките между атомите определят дали една молекула е реактивна, полярна, разтворима във вода и т.н. При химични реакции молекулите се разпадат и образуват нови молекули чрез прекъсване и образуване на химични връзки.
Строеж и химични връзки
- Ковалентни връзки: общи електронни двойки между два атома — основният механизъм за свързване в молекулите. Пример: H–H в молекулата на водорода (H2).
- Полярност: ако електронната плътност е неравномерно разпределена, молекулата може да бъде полярна (например H–O–H в водата), което определя дълбоко физични свойства като точка на кипене и разтворимост.
- Резонанс и делокализация: в някои молекули електроните са делокализирани по няколко връзки (напр. бензен), което влияе върху стабилността и реактивността.
- Валентност и изключения: в общи линии кислородът образува две връзки, въглеродът четири, азотът три, но в определени съединения и при радикали/координационни комплекси може да има отклонения.
Видове молекули
- Едноатомни молекули: състоят се от един атом (например благородните газове He, Ne). Тези "молекули" се разглеждат така в газовата кинетика.
- Двоични (диатомни) молекули: съставени от два еднакви или различни атома — H2, O2, N2, CO.
- Полиелементарни (полиатомни) молекули: тричленни и по-сложни — H2O, NH3, CH4, C6H6 и т.н.
- Молекулни съединения срещу йонни съединения: Молекулите са характерни за ковалентните съединения; в йонните вещества (напр. NaCl) структурните единици са йони, а не дискретни молекули.
- Изомери: едно и също молекулно съотношение може да доведе до различни структури (изомери) с различни физични и химични свойства.
Молекулни формули: видове и примери
Има няколко начина да се запише съставът на молекулата:
- Молекулна формула: изброява точния брой от всеки елемент в молекулата — например вода H2O, въглероден диоксид CO2, метан CH4.
- Емпирична формула: дава най-простото целочислено отношение между елементите. Пример: за пероксид вода H2O2 емпиричната формула е HO.
- Кондензирана/структурна формула: показва връзките и подреждането на атомите (напр. CH3CH2OH за етанол) — важна за разликата между изомерите.
Няколко често срещани примера с молекулни формули:
- Водород — H2
- Кислород — O2
- Азот — N2
- Вода — H2O
- Въглероден диоксид — CO2
- Метан — CH4
- Бензен — C6H6
- Глюкоза — C6H12O6 (срв. с горния пример за молекулна формула)
Физични свойства, молекулна маса и количество вещество
Молекулната маса (или моларна маса) е сумата от относителните атомни маси на всички атоми в молекулата и се измерва в g·mol−1. За практическо пресмятане на броя молекули в дадено количество вещество служи Авогадровото число (6.022·1023 частици = 1 mol). Например една молекула вода има относителна маса ≈ 18.015 g·mol−1 (за един мол).
Физичните свойства като точка на топене и кипене, разтворимост, проводимост и механични свойства зависят от вида на молекулните взаимодействия (водородни връзки, дипол-дипол, дисперсионни сили) и от структурата на молекулата.
Значение в природата и техниката
Молекулите са основни за биологичните процеси (ДНК, белтъци, въглехидрати), за синтеза на лекарства, пластмаси, горива и много други материали. Разбирането на молекулната структура и свойства е фундаментално за химията, биологията, материалознанието и фармацията.
Ако желаете, мога да добавя и конкретни структурни формули, 3D изгледи на молекули или да обясня как се определят молекулни маси и формули стъпка по стъпка с примери.
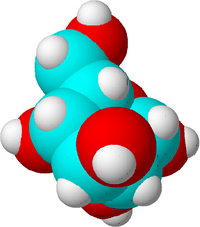
Това е молекула на захар. Въглеродните атоми са представени в синьо, кислородните - в червено, а водородните - в бяло, за да се покаже разликата. В действителност атомите нямат цвят.
Свързване
За да съществува една молекула, атомите трябва да се слепват. Това се случва, когато два атома споделят електрони. Вместо да обикаля само около един атом, електронът вече обикаля около два. Това се нарича ковалентна връзка. Понякога се споделя повече от един електрон. Колкото повече електрони са споделени, толкова по-силна е връзката и толкова по-силно атомите се придържат един към друг.
Връзките също могат да бъдат разкъсани. Тъй като за образуването на повечето връзки е необходима енергия, при разкъсването им те също отделят енергия. Но преди повечето връзки да се разкъсат, молекулата трябва да се нагрее. Тогава атомите започват да се движат и когато се движат твърде много, връзката се разкъсва. Молекулите, които изискват по-малко енергия за разкъсване, отколкото отделят при разкъсване, се наричат горива. Например една свещ просто си стои и нищо не се случва. Но когато използвате запалка, за да я запалите, тя ще гори дълго време. Запалката внася енергия за разкъсване на първите връзки, които освобождават достатъчно енергия за разкъсване на връзките под тях, докато свещта не изгори докрай.
Съществуват и йонни връзки.
Въпроси и отговори
В: Какво е молекула?
О: Молекулата е най-малкото количество химично вещество, което може да съществува. Тя е съставена от атоми, които са залепени един за друг в определена форма или вид.
В: Колко връзки имат атомите на кислорода, въглерода и азота?
О: Кислородните атоми винаги имат две връзки с други атоми, въглеродните атоми винаги имат четири връзки с други атоми, а азотните атоми винаги имат три връзки с други атоми.
В: Какво твърди кинетичната теория на газовете за молекулите?
О: Според кинетичната теория на газовете терминът "молекула" често се използва за всяка газова частица, независимо от нейния състав. Това означава, че атомите на благородните газове се смятат за молекули, тъй като те всъщност са едноатомни молекули.
Въпрос: Как се държат молекулите в различни състояния?
О: В газове като въздуха молекулите просто летят наоколо. В течностите като водата молекулите са слепени една с друга, но все още могат да се движат. В твърдите тела като захарта молекулите могат само да вибрират. В плазмата (четвъртото състояние на материята) атомите са йонизирани и не могат да образуват молекули.
Въпрос: Какво представлява молекулната формула?
О: Молекулната формула се използва за записване на номерата на всички атоми в молекулата. Например C6H12O6 означава една молекула глюкоза, която е съставена от шест въглеродни атома, дванадесет водородни атома и шест кислородни атома.
обискирам