Въглерод (C) — свойства, роля в живота и промишлеността
Въглерод (C) — ключов елемент в живота и промишлеността: свойства, алотропи и ролята му в биологията, стоманата и енергийните източници.
Въглеродът е много важен химичен елемент с химичен символ С. Той е необходим на всички познати видове живот на Земята. Въглеродът има атомна маса 12 и атомен номер 6. Той е неметал, което означава, че не е метал.
Когато желязото се легира с въглерод, се получава твърда стомана. Въглеродът под формата на въглища е важно гориво.
Физични и химични свойства
Въглеродът е химически много гъвкав елемент. Има четири валентни електрона, което му позволява да образува стабилни единични, двойни и тройни ковалентни връзки с други въглеродни атоми и с много други елементи. Тази способност да свързва дълги вериги от атоми (кацетиране) е основата на органичната химия и на богатото разнообразие от въглеродни съединения.
- Атомни данни: атомен номер 6; относителна атомна маса ≈ 12.011 (стандартна стойност за естествено срещащ се въглерод).
- Оксидни състояния: най-често +4 и +2 в неорганични съединения; в органичните молекули обикновено се разглежда като образуващ ковалентни връзки.
- Химична активност: сам по себе си чистият въглерод е относително инертен при стайна температура, но реагира при високи температури (изгаряне, карбонизационни процеси).
Алотропни форми
Въглеродът съществува в няколко алотропни форми с много различни свойства:
- Диамант – кристална решетка, където всеки въглероден атом е тетраедрично свързан с четири други; изключително твърд, прозрачен, отличен топлинен проводник.
- Графит – слоеста структура; силни връзки в рамките на слоевете, а слабите връзки между слоевете позволяват плъзгане (поява на смазващи свойства и използване в моливи и електроди).
- Графен – единичен слой въглеродни атоми в шестоъгълна мрежа; уникални електронни и механични свойства, важен за нанотехнологиите.
- Фулерените и въглеродните нанотуби – сферични и тръбни структури с обещаващи приложения в електроника, материали и медицина.
- Аморфен въглерод – включва въглен, сажди и активен въглен; различава се по порьозност и повърхностни свойства.
Роля в живота и биологията
Въглеродът е фундаментален градивен елемент за всички биомолекули: въглехидрати, липиди, протеини, нуклеинови киселини (ДНК и РНК) и множество други метаболити. Органичната химия е науката за съединенията на въглерода. Основни процеси, свързани с въглерода в природата:
- Фотосинтеза: растенията и някои микроорганизми преобразуват CO2 в органични молекули, като използват слънчева енергия.
- Дишане и разлагане: при клетъчното дишане и разлагането на органично вещество се отделя въглерод под формата на CO2 или метан (CH4).
- Въглероден цикъл: обменът на въглерод между атмосферата, хидросферата, литосферата и биосферата регулира климата и плодородието.
Промишлени приложения
Въглеродът и неговите съединения имат широк спектър от приложения в индустрията:
- Металообработка: добавянето на въглерод към желязото (легиране) променя свойствата и води до образуване на стомана с различна твърдост и якост.
- Горива: Въглища, нефт и природен газ са основни източници на енергия; остатъчни продукти от тях, като кокс, се използват в металургията.
- Пластмаси и синтетични материали: органичните полимери са изградени от въглеродни мономери (полиестер, полиетилен, полипропилен и др.).
- Специални материали: въглеродни влакна (carbon fiber) за леки и здрави конструкции; активен въглен за пречистване и филтрация; диаманти за режещи инструменти.
- Електроника и нанотехнологии: графен, въглеродни нанотуби и фулерени се проучват за приложения в електроника, сензори и медицински устройства.
- Енергетика и акумулатори: въглеродни електроди, катализатори и материали за акумулатори и горивни клетки.
Изотопи и приложения
- C‑12 – най-разпространеният стабилен изотоп; стандарт за относителна атомна маса.
- C‑13 – стабилен, използва се в ЯМР спектроскопия и като маркер в биологични и екологични изследвания.
- C‑14 – радиоактивен, широко използван за датировка (въглеродно датиране) на археологични и геоложки образци.
Въглерод и околна среда
Съединенията на въглерода, особено въглеродният диоксид (CO2) и метанът (CH4), играят ключова роля в парниковия ефект и глобалното затопляне. Изгарянето на изкопаеми горива освобождава големи количества CO2 в атмосферата, което води до промени в климата. Намаляването на емисиите, улавянето и съхранението на въглерод (CCS) и преходът към възобновяеми източници са сред основните мерки за ограничаване на въздействието.
Как се добива и използва
- Елементарният въглерод се добива чрез коксуване на въглища, преработка на нефт и други карбонизиращи процеси.
- Органични съединения богати на въглерод се произвеждат чрез синтез и рефинерия на петрохимични продукти.
- Напредъкът в синтеза на нови въглеродни материали (графен, нанотрубки, композити) разширява приложенията в бъдещите технологии.
Ключови факти — обобщение
- Въглеродът е основният елемент на живота и на голяма част от материалите, с които работим.
- Алотропните му форми определят широкия диапазон от физични и химични свойства.
- Икономическите и екологичните последици от употребата на въглеродни горива правят управлението на въглеродните емисии важен глобален приоритет.
Този преглед дава обща картина на свойствата, биологичната значимост и промишленото значение на въглерода. За по-задълбочена информация в определена област (напр. наноматериали, енергетика или органична химия) може да се разгледат специализирани източници или да зададете конкретен въпрос.
Химия на въглерода
Цял един вид химия, наречен органична химия, се занимава с въглерода и неговите съединения. Въглеродът образува много видове съединения. Въглеводородите са молекули с въглерод и водород. Метанът, пропанът и много други горива са въглеводороди. Много от веществата, които хората използват ежедневно, са органични съединения.
Въглеродът, водородът, азотът, кислородът и някои други елементи, като сяра и фосфор, заедно образуват по-голямата част от живота на Земята (вж. Списък на биологично важните елементи). Въглеродът образува много голям брой органични съединения, тъй като може да образува силни връзки със себе си и с други елементи. Поради количеството въглерод, което имат живите организми, всички органични вещества се считат за "въглеродни".
Всеки въглероден атом обикновено образува четири химични връзки, които представляват здрави връзки с други атоми, за да се образуват молекули. Връзката, която прави въглеродът, се нарича ковалентна връзка. Тези връзки позволяват на въглерода да образува много видове малки и големи молекули. Молекулата на метана е най-малката; тя има четири водородни атома, свързани с въглерода. Връзките могат да бъдат двойни, което означава, че се образуват две връзки между въглерода и друг атом, за да се направи по-силна връзка. Например въглеродният диоксид има два кислородни атома и всеки от тях е двойно свързан с въглерода. Въглеродът може да образува дори три връзки с друг атом, което се нарича тройна връзка. Например в газа ацетилен въглеродът образува тройна връзка с друг въглероден атом.
Свързвайки се с други въглеродни атоми, въглеродът може да образува дълги верижни молекули, наречени полимери, като например пластмаси и протеини. Атоми на други елементи могат да бъдат част от дългите полимерни вериги, често азот или кислород.
Чистият въглерод образува диамант, като се свързва с четири други въглеродни атома в триизмерен кристал. Той образува графит, като се свързва с три други въглеродни атома и образува тънки плоски слоеве.
Етимология
Названието на въглерода идва от латинското carbo, което означава въглен. В много чужди езици думите въглерод, въглен и дървени въглища са синоними.
Видове въглерод
Въглеродът в природата се среща в три форми, наречени алотропи: диамант, графит и фулерени. Графитът, заедно с глината, се съдържа в моливите. Той е много мек. Въглеродните атоми в него образуват пръстени, които са един върху друг и се плъзгат много лесно. Диамантите са най-твърдите природни минерали. Фулерените са въглерод с форма на "футболна топка". Те представляват интерес най-вече за науката. Специален, създаден от човека алотроп на въглерода с форма на тръба е въглеродната нанотръба. Въглеродните нанотръбички са много твърди, така че могат да се използват в бронята. Нанотръбите могат да бъдат полезни в нанотехнологиите.
Известни са 10 милиона въглеродни съединения.
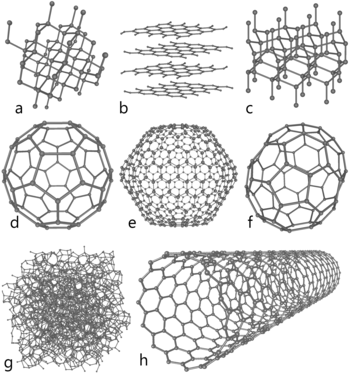
Някои форми на въглерода: а) диамант; б) графит; в) лонсдейлит; г-г) фулерени (С60, С540, С70); ж) аморфен въглерод; з) въглеродна нанотръба.
Радиовъглеродно датиране
Радиоактивният изотоп на въглерода, въглерод-14, може да се използва за определяне на възрастта на някои предмети или на момента на смъртта им. Докато нещо се намира на повърхността на Земята и приема въглерод, количеството на въглерод-14 остава едно и също. Когато даден обект спре да приема въглерод, количеството на въглерод-14 намалява. Тъй като периодът на полуразпад (за колко време изчезва половината от радиоактивен изотоп) на въглерод-14 е 5730 години, учените могат да определят възрастта на обекта по това колко въглерод-14 е останал.
Където въглеродът е
Въглеродът се намира на много места във Вселената. За първи път е създаден в стари звезди. Въглеродът е четвъртият най-разпространен елемент в Слънцето. Атмосферите на Венера и Марс са съставени предимно от въглероден диоксид.
Въглеродът е важен за човешкия организъм и други живи същества и е вторият най-разпространен елемент в човешкото тяло - 23% от цялото телесно тегло. Той е и основна част от много биологични молекули (молекули, използвани в живота).
По-голямата част от въглерода на Земята е от въглища. Графит има в много (обикновено пустинни) райони, включително в Шри Ланка, Мадагаскар и Русия. Диамантите са рядкост и се намират предимно в Африка. Въглерод има и в някои метеорити.
Свързани страници
- Списък на общите елементи
- Въглероден цикъл
Въпроси и отговори
Въпрос: Какъв е химическият символ на въглерода?
О: Химическият символ на въглерода е С.
В: Каква е атомната маса на въглерода?
О: Атомната маса на въглерода е 12.
В: Какъв е атомният номер на въглерода?
О: Атомният номер на въглерода е 6.
В: Въглеродът метал ли е или неметал?
О: Въглеродът е неметал, което означава, че не е метал.
В: Как желязото и въглеродът образуват твърда стомана, когато се легират заедно?
О: Когато желязото и въглеродът се легират заедно, те образуват твърда стомана.
В: Какъв вид гориво може да се създаде от въглища, които съдържат голямо количество въглерод?
О: Въглищата, които съдържат голямо количество въглерод, могат да се използват за създаване на важен източник на гориво.
обискирам