Протеини: структура, синтез и биологични функции в клетките
Протеини: изчерпателен преглед на структура, синтез и клетъчни функции — аминокиселини, нагъване, модификации и ролята им в здравето и метаболизма.
Протеините са дълговерижни молекули, изградени от малки единици, известни като аминокиселини. Те са свързани помежду си с пептидни връзки.
Те са биохимични съединения, състоящи се от един или повече полипептиди, сгънати в кръгла или влакнеста форма.
Полипептидът е единична линейна полимерна верига от аминокиселини. Последователността на аминокиселините в полипептида идва от ДНК последователността на даден ген. Генетичният код определя 20 стандартни аминокиселини. Малко след синтеза някои аминокиселини се модифицират по химичен път. Това променя нагъването, стабилността, активността и функцията на протеина. Понякога към белтъците се присъединяват непептидни групи като кофактори.
Протеините са от съществено значение за всички клетки. Подобно на други биологични макромолекули (полизахариди и нуклеинови киселини), белтъците участват в почти всички процеси в клетките:
- Катализ на реакции — голяма част от ензимите са протеини и ускоряват биохимични реакции.
- Транспорт — протеини като хемоглобин пренасят газове, а мембранни транспортни белтъци преместват йони и молекули през клетъчните бариери.
- Структурна поддръжка — протеини като актин, тубулин и колаген формират клетъчния скелет и извънклетъчни матрици.
- Сигнализация и рецепция — рецепторите и сигналните протеини предават външни и вътрешни сигнали.
- Двигателна функция — моторни протеини (миозин, кинезин, динеин) осигуряват движение в клетките и между тях.
- Имунен отговор — антителата и много имунни ефектори са протеини.
- Съхранение — някои протеини служат за резерви от аминокиселини или хранителни вещества (например феритин).
- Регулация на генната експресия — транскрипционни фактори и протеини, свързани с хроматина, контролират кои гени се изразяват.
- Контрол на цикъла на клетката и апоптоза — протеини регулират деленето и програмираната клетъчна смърт.
Структура на протеините
Протеините се описват чрез няколко структурни нива:
- Първична структура — линейната последователност на аминокиселините, свързани с пептидни връзки.
- Вторична структура — локални елементи като α-спирали и β-листове, стабилизирани чрез водородни връзки.
- Третична структура — триизмерното нагъване на цялата полипептидна верига, определяно от взаимодействия между страничните вериги (хидрофобни взаимодействия, йонни връзки, дисулфидни връзки и др.).
- Кватернерна структура — при протеини, съставени от няколко полипептидни субединици, тяхното взаимодействие и подреждане.
Синтез на протеините
Синтезът на протеини включва две основни стъпки:
- Транскрипция — копиране на генетичната информация от ДНК в информационна РНК (иРНК) в ядрата на еукариотните клетки (или в цитоплазмата при прокариотите).
- Транслaция — превеждане на последователността на иРНК в аминокиселинна последователност на рибозомите. Този процес изисква тРНК молекули, аминокиселни активиращи ензими, енергия (GTP, ATP) и множество фактори за инициация, елонгация и терминация.
Някои белтъци се синтезират ко-транслaционно и се вкарват в ендоплазмения ретикулум чрез сигнални пептиди, след което се сортират към апарата на Голджи, мембраните или извън клетката.
Посттранслационни модификации и нагъване
След синтез протеините често претърпяват модификации, които регулират тяхната функция, локализация и стабилност. Част от важните модификации:
- Фосфорилиране — често регулира активността и взаимодействията на протеини в сигнални пътища.
- Гликозилиране — добавяне на въглехидратни групи, важно за мембранни и секретирани протеини.
- Убиквитиниране — маркиране за разграждане или регулация на функцията.
- Протеолитично активиране — много ензими и хормони се синтезират като неактивни прекурсори и се активират чрез частично протеолитично разцепване.
- Дисулфидни връзки — формиране между цистеинови остатъци, стабилизиращи третичната структура при секретирани протеини.
Нагъването на протеините често се подпомага от шаперони — специализирани протеини, които предотвратяват неправилното агрегиране и подпомагат достигането на функционалната конформация.
Разграждане и контрол на качеството
Клетките имат сложни механизми за контрол на качеството на протеините и за разграждането на дефектни или стари белтъци:
- Убиквитин-протеазомна система — главен път за разграждане на белтъци в цитозола и ядрото.
- Автофагия и лизозомно разграждане — за по-големи структури, агрегати или органели.
- ERAD (Endoplasmic Reticulum-Associated Degradation) — система за откриване и премахване на неправилно сгънати протеини в ендоплазмения ретикулум.
Методи за изучаване на протеините
За изследване на структура, функция и количество на протеините се използват множество техники:
- Кристалография на рентгенови лъчи, NMR спектроскопия и крио-електронна микроскопия (cryo-EM) — за определяне на високоразрешителни триизмерни структури.
- Мас-спектрометрия — за идентификация, определяне на маса и откриване на посттранслационни модификации.
- SDS-PAGE и Western blot — за разделяне и откриване на протеини по размер и с помощта на антитела.
- Флуоресцентна микроскопия и белтъчно маркиране — за проследяване на локализация и динамика в живи клетки.
Клинично значение и болести, свързани с протеини
Неправилно нагъване, дефекти в синтеза или в разграждането на протеини могат да доведат до болести:
- Невродегенеративни заболявания — натрупване на неправилно нагънати белтъци (например болестта на Алцхаймер, Паркинсон, болестта на Хънтингтън).
- Прйони — инфекциозни, неправилно нагънати протеини, причиняващи спонгиформни енцефалопатии.
- Генетични мутации — могат да променят структурата и функцията на ензими и структурни белтъци (например мутации, водещи до цистична фиброза или сърповидно-клетъчна анемия).
- Автоимунни и метаболитни заболявания — често включват антитела срещу специфични протеини или дефицит на ензими.
Еволюция и разнообразие
Протеините показват огромно разнообразие във форма и функция. Последователностите им се променят в хода на еволюцията чрез генетични мутации, рекомбинации и генни дупликации, което позволява възникването на нови функции и адаптация към различни биологични ниши.
Кратко обобщение
Протеините са основни биомолекули, които чрез своята структура, синтез и посттранслационни модификации изпълняват разнообразни и незаменими функции в клетките — от катализа и транспорт до структурна поддръжка, сигнализация и имунен отговор. Разбирането на техните свойства и механизми е централно за биологията, медицината и биотехнологиите.
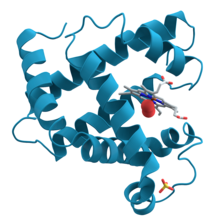
Триизмерна диаграма на белтъка миоглобин, показваща тюркоазените алфа-спирали. Структурата на този белтък за първи път е решена чрез рентгенова кристалография. Към десния център сред спиралите е разположена хемна група (показана в сиво) със свързана кислородна молекула (червено)
Протеини за хора
Протеините имат различни функции в зависимост от формата си. Те се съдържат в месото или мускулите. Те се използват за растеж и възстановяване, както и за укрепване на костите. Те помагат за изграждането на тъкани и клетки. Намират се в животните, растенията, гъбите, бактериите, а също и в човешкото тяло.
Мускулите съдържат много протеини. При усвояването на протеините те се разграждат на аминокиселини. Тези аминокиселини могат да се използват за изграждане на нов протеин. Протеините представляват важна част от храни като мляко, яйца, месо, риба, боб, спанак и ядки. Съществуват четири фактора, които определят какво ще прави даден протеин. Първият е редът на аминокиселините. Съществуват 20 различни вида аминокиселини. Вторият е малките усуквания във веригата. Третият е начинът, по който е сгъната цялата структура. Четвъртият е дали е съставен от различни подединици. Молекулите на хемоглобина например се състоят от четири подединици.
Увреждащи мутации
Повечето протеини са ензими и мутациите могат да забавят или да спрат работата им. 50% от раковите заболявания при човека се дължат на мутации в туморния супресор p53. p53 е белтък, който регулира клетъчното делене.
Есенциални аминокиселини
Протеините са необходими в храната на животните, тъй като те не могат да произвеждат всички необходими аминокиселини (могат да произвеждат повечето от тях). Те трябва да получават определени аминокиселини от храната. Те се наричат незаменими аминокиселини. Чрез храносмилането животните разграждат приетите белтъчини до свободни аминокиселини. След това аминокиселините се използват в метаболизма за производството на ензими и структури, от които тялото се нуждае.
Съществуват девет незаменими аминокиселини за човека, които се набавят от храната. Деветте незаменими аминокиселини са: хистидин, изолевцин, левцин, лизин, метионин, фенилаланин, треонин, триптофан и валин. Месото съдържа всички незаменими аминокиселини, от които се нуждае човек; повечето растения не съдържат такива. Въпреки това консумирането на смес от растения, като например едновременно пшеница и фъстъчено масло или ориз и боб, осигурява всички необходими незаменими аминокиселини. Соевите продукти като тофу осигуряват всички незаменими аминокиселини, както и киноата, но те не са единственият начин за набавяне на необходимите на човека протеини.
Ученият Йонс Якоб Берцелиус дава името на протеините, но много други учени са ги изучавали.

Яйчните белтъци съдържат много протеини
Свързани страници
Въпроси и отговори
В: Какво представляват протеините?
О: Протеините са дълговерижни молекули, изградени от малки единици, известни като аминокиселини.
В: Как се свързват аминокиселините?
О: Аминокиселините се свързват с пептидни връзки.
В: Какво представлява полипептидът?
О: Полипептидът е единична линейна полимерна верига от аминокиселини.
В: Откъде идва последователността на аминокиселините в полипептида?
О: Последователността на аминокиселините в полипептида идва от ДНК последователността на гена.
В: Какво се случва с някои аминокиселини малко след синтеза?
О: Скоро след синтеза някои аминокиселини се модифицират химически.
Въпрос: Как се модифицират аминокиселините в протеините?
О: Модификацията на аминокиселините в протеините променя нагъването, стабилността, активността и функцията на протеина.
В: Всички белтъци ли са съставени само от аминокиселини?
О: Не, понякога към белтъците се присъединяват непептидни групи като кофактори.
обискирам