Сгъване на белтъци: как се формира функционалната триизмерна структура
Как аминокиселинната последователност формира функционална 3D структура на белтъците, влияние върху функцията, болести и имунни реакции.
Сгъването на белтъците е процесът, при който белтъкът придобива своята функционална форма или "конформация". Това е предимно самоорганизиращ се процес: започвайки от случайна намотка, полипептидите се сгъват в характерната си работна форма. Структурата се държи заедно чрез различни взаимодействия, сред които важна роля играят водородни връзки, но също така и хидрофобни ефекти, йонни взаимодействия, ван дер Ваалсови сили и при някои белтъци — дисулфидни връзки (S–S).
Етапите са:
- Всеки белтък съществува като разгънат полипептид или случайна спирала, когато се транслира от последователността на мРНК в линейна верига от аминокиселини. Този полипептид няма развита триизмерна структура (лявата страна на горната фигура). При изходното разгънато състояние (unfolded) аминокиселинните странични вериги са изложени на разтворителя и могат да взаимодействат с околната среда.
- Аминокиселините взаимодействат помежду си, за да се получи добре дефинирана триизмерна структура - нагънат протеин (дясната страна на фигурата). Това е известно като нативно състояние. Получената триизмерна структура се определя от последователността на аминокиселините (догмата на Анфинс). Нативното състояние обикновено съответства на минимума на свободната енергия при дадени физико-химични условия (температура, pH, йонна сила).
- Междинни състояния и пътища на сгъване: процесът често минава през краткотрайни междинни структури (частично сгънати форми). Сгъването не е винаги линейно — съществуват множество възможни пътеки, описвани концептуално с модела на "фунията на сгъване" (folding funnel), при който полипептидът постепенно намалява свободната си енергия и навлиза в по-стабилни конфигурации.
- Които белтъци се разграждат и които остават частично разгърнати: без правилната си триизмерна структура белтъкът не функционира. Въпреки това много белтъци имат участъци, които остават мобилни или без строго дефинирана структура — т.нар. интринзично неструктурирани региони (IDPs). Тези гъвкави участъци често участват в регулация и свързване с други молекули.
Ключови сили и фактори, влияещи на сгъването
Хидрофобният ефект подтиква неполярните странични вериги да се скриват от водата в сърцевината на белтъка. Водородните връзки стабилизират вторичната структура (α-спирали и β-слоеве). Йонни връзки (солни мостове) и ван дер Ваалсови взаимодействия допринасят за точното прилепване на частите. Ковалентните дисулфидни връзки между цистеини могат да „закотвят“ определена конформация, особено при екстрацелуларни белтъци. Посттранслационни модификации, свързването на метални йони или кофактори също влияят върху окончателната форма.
Сгъване в клетката vs. in vitro
Вътре в клетката процесът протича в стеснена и „претоварена“ среда (molecular crowding), където концентрациите на макромолекулите са високи. Това променя кинетиката и термодинамиката на сгъване. Много белтъци се сгъват ко-транслативно — тоест започват да придобиват структура още докато се синтезират на рибозомата. Клетката използва и молекулни шапки (chaperones) и chaperonins, които подпомагат правилното сгъване и ограничават агрегиране.
Неправилно сгъване и заболявания
Ако белтъците не се сгънат в естествената си форма, те могат да бъдат неактивни и често да образуват токсични агрегати. Смята се, че няколко добре познати невродегенеративни заболявания са резултат от неправилно нагънати протеини — например болестите на Алцхаймер, Паркнсън, Хънтингтън и прионните болести, при които се формират устойчиви амилоидни влакна. Много алергии се причиняват от сгъването на белтъците, тъй като имунната система не произвежда антитела за всички възможни структури на белтъците. Накратко, агрегиралите или неправилно сгънатите белтъци могат да предизвикат клетъчни нарушения и патологични реакции.
Как се изучава сгъването
Изследователите използват комбинация от методи: рентгенова кристалография, NMR, крио-електронна микроскопия за структурни детайли; кръгова дихроизъм и флуоресцентни техники за следене на вторичната структура и кинетиката; спринт-флоу и единично-молекулни измервания (single-molecule FRET) за проследяване на пътищата на сгъване в реално време. Биофизичните модели и компютърните симулации допълват експерименталните данни.
Практически значения
Разбирането на механизма на сгъване е ключово за биотехнологиите (например правилна експресия на рекомбинантни белтъци), за проектиране на стабилни протеини и за разработване на терапии срещу заболявания, свързани с агрегиране. Контролът на условията на средата, подпомагането чрез шапки или инженерни промени в последователността могат да подобрят добива и активността на функционалните белтъци.
В резюме: сгъването на белтъците е резултат от комплексно взаимодействие между тяхната аминокиселинна последователност и околната среда, водещо към енергетично благоприятна, функционална триизмерна структура. Неправилното сгъване има важни биологични и медицински последици, което прави изследването му централна тема в молекулярната биология и медицината.
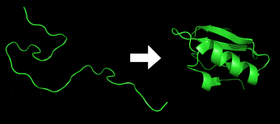
Протеин преди и след сгъване
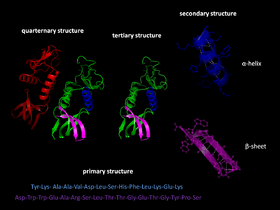
Сгъването на протеините е третият етап от развитието на протеиновата структура.
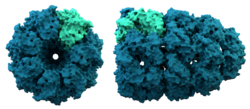
Структура на шаперонин. Шаперонините подпомагат нагъването на някои протеини.
Шаперони
Шаперонините са големи белтъци, които подпомагат сгъването на някои белтъци след синтеза им. Шапероните като цяло са открити за първи път, когато помагат на хистоните и ДНК да се съединят, за да образуват нуклеозоми. Нуклеозомите са градивните елементи на хромозомите. Вече е ясно, че по този начин се изграждат много клетъчни органели.
Въпроси и отговори
В: Какво представлява сгъването на протеините?
О: Сгъването на белтъците е процесът, при който полипептидната верига се превръща от разгъната линейна верига от аминокиселини в характерната си триизмерна форма.
В: Какво държи структурата заедно?
О: Структурата на сгънатия протеин се държи заедно чрез водородни връзки.
В: Кои са етапите на сгъване на белтъка?
О: Етапите на сгъване на белтъка включват разгънат полипептид или случайна намотка при транслирането му от мРНК до линейна верига от аминокиселини, след което взаимодействат помежду си, за да се получи добре дефинирана триизмерна структура, известна като нативно състояние.
Въпрос: Какво се случва, ако белтъците не се сгъват правилно?
О: Ако белтъците не се сгънат в естествената си форма, те са неактивни и обикновено са токсични. Това може да доведе до редица заболявания и алергии, причинени от неправилно сгънати протеини, които имунната система не разпознава.
Въпрос: Кой е разрешил проблема със сгъването на протеините през 2020 г.?
О: На 30 ноември 2020 г. проблемът със сгъването на протеините беше решен от компанията за изкуствен интелект DeepMind.
Въпрос: Каква е догмата на Анфинсен? О: Догмата на Анфинсен гласи, че получената триизмерна структура на сгънат протеин се определя от неговата аминокиселинна последователност.
обискирам