Аминокиселина: определение, структура, функции и есенциални видове
Научете всичко за аминокиселините: дефиниция, структура, функции в протеините и есенциалните (незаменими) видове — значението им за здраве и хранене.
Аминокиселините са градивните елементи на протеините. При еукариотите има 20 стандартни аминокиселини, от които се изграждат почти всички белтъци.
В биохимията аминокиселина е всяка молекула, която има едновременно аминна (NH2+R) и карбоксилна (C=O) функционална група. В биохимията този термин се отнася за алфа-аминокиселини с обща формула H2NCHRCOOH, където R е една от многото странични групи (вж. схемата).
Известни са около 500 аминокиселини. За животните най-важното нещо, което правят аминокиселините, е да създават протеини, които са много дълги вериги от аминокиселини. Всеки белтък има своя собствена последователност от аминокиселини и тази последователност кара белтъка да приема различни форми и да има различни функции. Аминокиселините са като азбуката за белтъците; въпреки че имате само няколко букви, ако ги свържете, можете да направите много различни изречения.
Девет от 20-те стандартни аминокиселини са "незаменими" аминокиселини за човека. Те не могат да бъдат изградени (синтезирани) от други съединения от човешкия организъм и затова трябва да се приемат с храната. Други могат да бъдат от съществено значение за някои възрасти или медицински състояния. Есенциалните аминокиселини могат да се различават и при различните видове. Билкоядните животни трябва да си набавят незаменимите аминокиселини от храната си, която при някои от тях е почти изцяло трева. Преживните животни, като кравите, получават някои аминокиселини чрез микробите в първите две камери на стомаха.
Химична структура и свойства
Алфа-аминокиселината има централно въглеродно (α-углеродно) атомно свързване към четири различни групи: аминна група (–NH2), карбоксилна група (–COOH), водороден атом и странична веригa (R). Именно различието в R-групата определя химичните и физичните свойства на всяка аминокиселина.
При физиологично pH повечето аминокиселини съществуват като зоцитерони — имат както положителен (протонирана аминна група), така и отрицателен (депротонирана карбоксилна група) заряд. Това ги прави амфотерни молекули, способни да действат като киселина или база.
Аминокиселините имат стереоизомерия: в протеините практически се използват само L-формите. D-аминокиселини се намират рядко и обикновено извън стандартните белтъци (напр. в някои бактериални клетъчни стени или пептидни антибиотични молекули).
Класификация според свойства на страничната група
- Неполярни (хидрофобни): глицин (малко и уникално), аланин, валин, левцин, изолевцин, пролин, метионин, фенилаланин, триптофан.
- Полярни без заряд: серин, треонин, цистеин, аспарагин, глутамин.
- Киселинни (отрицателно заредени): аспарагова (аспартат), глутамова (глутамат).
- Основни (положително заредени): лизин, аргинин, хистидин.
Пептидни връзки и нива на структура на белтъците
Аминокиселините се свързват чрез пептидни връзки — амидни връзки между карбоксилната група на една аминокиселина и аминната група на следващата, с отделяне на вода. Редът на аминокиселините (последователността) определя първичната структура на белтъка. Следват вторична (α-спирали, β-листове), третична (пространствена конфигурация) и четвъртична (събиране на субединици) структури.
Биологични функции
Аминокиселините и белтъците, изградени от тях, изпълняват множество жизненоважни роли:
- Катализ на реакции — ензими.
- Структурна функция — колаген, кератин.
- Транспорт и съхранение — хемоглобин, мембранни транспортери.
- Сигнални молекули и хормони — инсулин, глюкагон.
- Имунна защита — антитела.
- Резервен източник на енергия и междинни метаболити — при нужда аминокиселините се разграждат за енергия или за синтез на други молекули.
Есенциални (незаменими) аминокиселини за човека
За възрастни хора девет аминокиселини се считат за незаменими, защото тялото не може да ги синтезира в достатъчни количества и трябва да се приемат с храната:
- Хистидин
- Изолевцин
- Левцин
- Лизин
- Метионин
- Фенилаланин
- Треонин
- Триптофан
- Валин
При някои възрастови групи (напр. кърмачета) или при болестни състояния някои други аминокиселини (като аргинин и хистидин) могат да бъдат условно есенциални.
Специални и нетипични аминокиселини
Освен стандартните 20, в белтъците понякога се вместват и други аминокиселини чрез специални механизми — напр. селенцистеин (наричан 21-ва аминокиселина) и пирролизин (в някои микроби). Има и много нефункционални или неканонични аминокиселини, които се срещат в природата (около 500 известни), но не всички участват в синтеза на белтъци.
След транслaция аминокиселините в белтъка могат да претърпят посттранслационни модификации — фосфорилиране, гликозилиране, метилиране, ацетилиране и др., които променят функцията на белтъка.
Синтез, разграждане и метаболизъм
Някои аминокиселини могат да се синтезират от организма (неесенциални), но други — не. При разграждане аминокиселините се дезаминират и въглеродните им скелети се използват в цикъла на Krebs или за глюконеогенеза. Нарушения в метаболизма на аминокиселините могат да доведат до наследствени болести (напр. фенилкетонурия при дефект в разграждането на фенилаланин).
Хранителни източници и значение за здравето
Пълноценните белтъчни храни (съдържащи всички есенциални аминокиселини) включват яйца, месо, риба, млечни продукти и соя. Растителни източници като бобови растения, ядки и зърнени храни често имат непълни аминокиселинни профили, но чрез комбиниране на различни растителни храни (напр. боб и ориз) се постига пълен набор от есенциални аминокиселини.
Адекватният прием на аминокиселини е важен за растежа, възстановяването след травми или хирургия, имунната функция и поддържането на мускулна маса. Дефицит или дисбаланс може да доведе до умора, забавен растеж, отслабване на имунитета и други здравословни проблеми.
Кратко обобщение
Аминокиселините са многофункционални органични молекули — градивни единици на белтъците и важни участници в метаболизма. Разнообразието на техните странични вериги позволява огромно разнообразие от структури и функции в живите организми. Разбирането на тяхната химия и ролята им в храненето и здравето е от ключово значение за биологията и медицината.
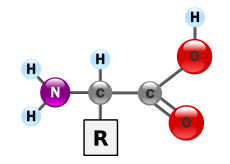
Аминокиселините са крайният продукт на белтъчините.Обща структура на α-аминокиселина, с аминогрупа вляво и карбоксилна група вдясно.
Структура
Аминокиселината е органичен химикал. Състои се от α-въглероден атом, който е ковалентно свързан с четири групи.
- водороден атом
- аминогрупа (-NH2)
- карбоксилна група (-COOH)
- променлива група R
Всяка аминокиселина има поне една аминогрупа (-NH2) и една карбоксилна група (-COOH), с изключение на пролина.
Генна експресия и биохимия
Това са протеиногенните аминокиселини, които са градивните елементи на протеините. Те се произвеждат от клетъчни механизми, кодирани в генетичния код на всеки организъм.
| Аминокиселини | Кратък | Съкращение. | Кодон(и) | Среща в | Essential‡ при хора |
| A | Ala | GCU, GCC, GCA, GCG | 7.8 | Не | |
| C | Cys | UGU, UGC | 1.9 | Условно | |
| Аспарагинова киселина | D | Asp | GAU, GAC | 5.3 | Не |
| Глутаминова киселина | E | Glu | GAA, GAG | 6.3 | Условно |
| Фенилаланин | F | Phe | UUU, UUC | 3.9 | Да |
| Глицин | G | Gly | GGU, GGC, GGA, GGG | 7.2 | Условно |
| Хистидин | H | Неговият | CAU, CAC | 2.3 | Да |
| Изолевцин | I | Ile | AUU, AUC, AUA | 5.3 | Да |
| Лизин | K | Lys | AAA, AAG | 5.9 | Да |
| Левцин | L | Leu | UUA, UUG, CUU, CUC, CUA, CUG | 9.1 | Да |
| Метионин | M | Met | AUG | 2.3 | Да |
| Аспарагин | N | Asn | AAU, AAC | 4.3 | Не |
| Пиролизин | O | Pyl | UAG* | 0 | Не |
| Proline | P | Pro | CCU, CCC, CCA, CCG | 5.2 | Не |
| Глутамин | Q | Gln | CAA, CAG | 4.2 | Не |
| Аргинин | R | Arg | CGU, CGC, CGA, CGG, AGA, AGG | 5.1 | Условно |
| Серин | S | Сер | UCU, UCC, UCA, UCG, AGU, AGC | 6.8 | Не |
| Треонин | T | Thr | ACU, ACC, ACA, ACG | 5.9 | Да |
| Селеноцистеин | U | Секция | UGA** | >0 | Не |
| Валин | V | Вал | GUU, GUC, GUA, GUG | 6.6 | Да |
| W | Trp | UGG | 1.4 | Да | |
| Y | Tyr | UAU, UAC | 3.2 | Условно | |
| Стоп кодон† | - | Срок | UAA, UAG, UGA†† | - | - |
* UAG обикновено е кехлибареният стоп кодон, но кодира пиролизин, ако е налице елемент PYLIS.
** UGA обикновено е стоп кодонът с цвят опал (или умбер), но кодира селеноцистеин, ако е налице елемент SECIS.
† Стоп кодонът не е аминокиселина, но е включен за пълнота.
†† UAG и UGA не винаги действат като стоп кодони (вж. по-горе).
‡ Есенциална аминокиселина не може да се синтезира при хората. Тя трябва да се набавя с храната. Условно незаменимите аминокиселини обикновено не се изискват в храната, но трябва да се доставят на популации, които не произвеждат достатъчно от нея.
Към тези α-аминокиселини, които по-нататък в процесите на биосинтеза се появяват неесенциални, са структурно свързани (тук чрез използване на SMILES нотация):
OC(=O)C(N)-
- ├ H .. V Глицин
- ├ C .. P Аланин
- │├ C .. 2-аминобутанова киселина
- ││├ C .. Norvaline
- │││├ -2H .. _ Пролин (дехидронорвалин)
- │││├ C .. Norleucine
- ││││└ N .. Z Лизин
- ││││ └ C(=O)C1N=CCC1C .. ^ Пиролизин
- │││└ NC(=N)N .. a Аргинин
- ││├ C(=O)N .. ` Глутамин
- ││├ C(=O)O .. T Глутаминова киселина
- ││├ O .. Хомосерин
- ││└ S .. Хомоцистеин
- ││ └ C .. \ Метионин
- │├ C(C)C .. [ Левцин
- │├ C(=O)N .. ] Аспарагин
- │├ C(=O)O .. S Аспарагинова киселина
- │├ C1=CNC=N1 .. W Хистидин
- │├ c1ccccc1 .. U Фенилаланин
- │├ c1ccc(O)cc1 .. h Тирозин
- │├ C1=CNc2ccccc12 .. f Триптофан
- │├ C1=CNc2ccc(O)cc12 ... Окситриптан
- │├ c(cc1I)cc(I)c1-O-c2cc(I)c(O)c(I)c2 ... Тироксин
- │├ O .. b Серин
- │├ S .. R Цистеин
- │└ [SeH] .. d Селеноцистеин
- ├ C(C)C .. e Валин
- ├ C(C)O .. c Треонин
- └ C(C)CC .. X Изолевцин
Въпроси и отговори
В: Какво представляват аминокиселините?
О: Аминокиселините са молекули, които имат както аминни (NH2+R), така и карбоксилни (C=O) функционални групи, и са градивните елементи на белтъците.
В: Колко "стандартни" аминокиселини съществуват при еукариотите?
О: В еукариотите има 20 "стандартни" аминокиселини, от които са изградени почти всички белтъци.
В: Каква е общата формула на алфа-аминокиселините?
О: Общата формула на алфа-аминокиселините е H2NCHRCOOH, където R е една от многото странични групи.
В: Какво се има предвид в биохимията, когато се говори за аминокиселини?
О: В биохимията терминът "аминокиселина" се отнася за алфа-аминокиселини с обща формула H2NCHRCOOH, където R е една от многото странични групи.
В: Как протеините получават своята структура?
О: Белтъците получават своята структура от комбинацията на различни видове аминокиселини.
В: Каква роля играят амино и карбоксилните функционални групи в молекулата на аминокиселината?
О: Аминните и карбоксилните функционални групи изграждат молекулата на аминокиселината; те осигуряват азотен атом, както и въглероден атом, които могат да образуват връзки с други молекули.
обискирам