Атомни орбитали: дефиниция, видове и значение в квантовата механика
Атомни орбитали — дефиниция, видове и ключово значение в квантовата механика. Лесно обяснение на електронните конфигурации и влиянието им върху химичните свойства.
Атомните орбитали са местата около ядрото на атома, където електроните най-вероятно ще се намират във всеки един момент. Това е математическа функция, която описва вълнообразното поведение на един електрон или на двойка електрони в атома.
Думата "орбитален" се използва, защото се смята, че електроните се държат подобно на слънчевата система, където ядрото е като слънцето, а електроните обикалят като планетите.
Броят на атомните орбитали в даден елемент се определя от периода, в който се намира елементът. Електроните се движат между орбиталите в зависимост от това колко бързо се движат и колко други електрони има.
В атомната теория и квантовата механика атомната орбитала е квантово число. Всяка такава орбитала може да бъде заета от един или два електрона. Начинът, по който са разположени орбиталите, е свързан с електронните конфигурации на атомите. Те са изведени от описанията, предоставени от ранните спектроскописти на някои спектрални линии на алкалните метали, като остри, главни, дифузни и фундаментални.
Какво точно представлява орбиталата
За да сме прецизни: орбиталата не е траектория или физическо "място" като орбита в класическия смисъл, а вълнова функция ψ(r,θ,φ) — математическа функция, решение на уравнението на Шрьодингер (за водородоподобни атоми). Вероятността да намерим електрона в малък обем около точка r е пропорционална на плътността |ψ|^2. Орбиталите се описват чрез набор от квантови числа, които определят енергията, формата и ориентацията им.
Квантови числа
- Главно квантово число n — определя енергийното ниво и относителния размер на орбитала (n = 1, 2, 3 ...).
- Главно орбитално квантово число l — свързано с формата на орбитала (l = 0, 1, ..., n−1). За l се използват буквите: 0 → s, 1 → p, 2 → d, 3 → f.
- Магнитно квантово число m (или m_l) — ориентацията на орбитала в пространството (m = −l ... +l), което дава 2l+1 възможни направления.
- Спиново квантово число m_s — описва спина на електрона (m_s = +1/2 или −1/2). Поради това една орбитала може да съдържа максимум два електрона със срещуположни спинове (принцип на Паули).
Видове орбитали и форми
Най-често обсъжданите видове са:
- s-орбитали (l=0) — сферично симетрични около ядрото.
- p-орбитали (l=1) — имат форма на „гантела“ (dumbbell) с три ориентации (m = −1, 0, +1).
- d-орбитали (l=2) — по-сложни четирилистни или дискобразни форми (пет ориентации).
- f-орбитали (l=3) — още по-сложни форми, важни за редките земни елементи и актините.
Енергия и подредба на орбиталите
При водородоподобните атоми енергията зависи само от n. В многоелектронните атоми взаимодействията между електроните променят енергийната подредба — тогава енергията зависи както от n, така и от l (shielding и penetration ефекти). Практическата подредба при запълване на орбиталите следва правилата на Aufbau, принципа на Паули и правилото на Хунд (попълване с паралелни спинове преди двойно заемане).
Преходи и спектроскопия
Преместването на електрон между орбитали е свързано с поглъщане или емисия на фотон с енергия точно равна на разликата между енергийните нива. Историчните названия на спектралните серии — остри, главни, дифузни и фундаментални — стоят в основата на обозначенията s, p, d, f.
От атомни орбитали към химични връзки
Атомните орбитали служат като основа за образуване на молекулни орбитали при свързване на атоми. Комбинацията и хибридизацията (например sp, sp2, sp3) определят геометрията и свойствата на молекулите. Познаването на формата и енергията на орбиталите е ключово за разбиране на реакционната способност, магнитните свойства и спектралните характеристики на веществата.
Къде се използва това знание
- Квантово-химични изчисления и моделиране на молекули;
- Интерпретация на спектри и определяне на енергийни нива;
- Разработка на материали и разбиране на проводимост, магнитизъм и каталитични свойства;
- Образование и фундаментална изследователска физика и химия.
Бележка за неточности в популярни описания: В популярните представи орбиталите често се описват по аналогия със слънчевата система, но това е само моделна интуиция. В квантовата механика електронът няма добре дефинирана траектория — разполагането му се дава само вероятностно чрез |ψ|^2. Също така орбитала не е самостоятелно „квантово число“ — тя се описва от набор от квантови числа (n, l, m, m_s).
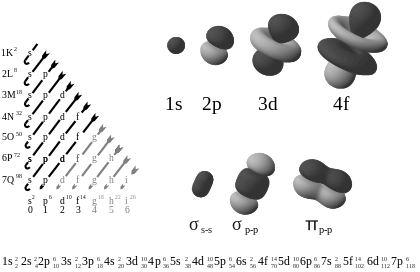
На диаграмата вляво са показани орбиталите в реда на нарастване на енергията. Вдясно са показани примери за формата на орбитите.
Свързани страници
- Електронен облак
- Молекулна орбитала
Въпроси и отговори
В: Какво представляват атомните орбитали?
О: Атомните орбитали са областите около ядрото на атома, в които най-вероятно се намират електрони.
В: Каква е математическата функция, която описва поведението на електроните в един атом?
О: Математическата функция, която описва поведението на електроните в атома, е вълнова функция.
В: Защо се използва думата "орбитален"?
О: Думата "орбитален" се използва за описване на областите около ядрото, в които най-вероятно се намират електрони, защото някога се е смятало, че електроните се държат като планети, които обикалят около слънцето.
В: Как се определя броят на атомните орбитали в даден елемент?
О: Броят на атомните орбитали в даден елемент се определя от периода на елемента.
В: Защо електроните се движат между орбитали?
О: Електроните се движат между орбитали в зависимост от скоростта си и броя на другите електрони.
В: Какво представлява атомната орбитала в атомната теория и квантовата механика?
О: Атомната орбитала е квантово число в атомната теория и квантовата механика.
В: Колко електрона може да заема всяка атомна орбитала?
О: Всяка атомна орбитала може да бъде заета от един или два електрона.
обискирам