Атомна теория – история, строеж на атома и ключови открития
Атомна теория: история, строеж на атома и ключови открития — от Демокрит до Далтън, протони, неутрони, електрони и съвременни пробиви за любознателни читатели
В областта на химията и физиката атомната теория обяснява как се е променило разбирането ни за атома с течение на времето. Някога се е смятало, че атомите са най-малките частици на материята. Сега обаче е известно, че атомите се състоят от протони, неутрони и електрони. Тези субатомни частици се състоят от кварки. Първата идея за атома е на гръцкия философ Демокрит. Голяма част от идеите в съвременната теория идват от Джон Далтън, британски химик и физик.
Теорията е приложима за твърди тела, течности и газове, но не е аналогична на плазмата или неутронните звезди. Причината е, че в плазмата голяма част от атомите са ионизирани и класическите модели на свързан електрон към ядро трябва да се преразгледат, а в неутронните звезди материята е компресирана до степени, при които преобладават неутрони и силите между нуклоните се проявяват по начин, неконвенционален за нормалната атомна материя.
Кратка историческа хронология
- Демокрит (ок. 5 в. пр.н.е.) — първата философска идея за неделима частица (атом).
- Джон Далтън (нач. на 19 в.) — възстановява идеята за атомите като основни единици на химическите елементи; формулира първите закони за относителните маси и комбинациите на елементите.
- J. J. Thomson (1897) — открива електрона чрез изследване на катодните лъчи; предлага "пудинг модел" на атома с положителен заряд, в който са вградени електрони.
- Ернест Ръдърфорд (1911) — експериментът със златно фолио показва, че положителният заряд и масата са концентрирани в малко ядро; през 1919 той идентифицира протона като ядро на водородния атом.
- Нилс Бор (1913) — предлага модел с квантовани орбити за електроните; обяснява спектъра на водорода и въвежда понятието атомно число (Z) като определящо химичните свойства.
- Джеймс Чадуик (1932) — открива неутрона, обяснявайки съществуването на изотопи и масовите различия между атомите на един и същи елемент.
- Среда на 20 в. — развитие на квантовата механика (Шрьодингер, Хайзенберг, Паули и др.), която заменя класическите представи за траектории с вероятностни електронни орбитали.
- 1960-те — формулиране на стандартния модел на елементарните частици; кварковата структура на протоните и неутроните (Гел-Ман, Звейг) е потвърдена експериментално по-късно чрез дълбоко нееластично разсейване.
Модели на атома — как се сменяха представите
- Пудинг модел (Thomson) — електроните са разположени в положителна "матрица".
- Ядрено (Ръдърфорд) — масата и положителният заряд са в компактно ядро; електроните обикалят на голямо относително разстояние.
- Боров модел — електроните заемат дискретни енергийни нива; преходите между нивата обясняват линейните спектри.
- Квантово-механичен модел — електроните не се описват с класически орбити, а с вълнови функции (орбитали), които дават вероятност за намиране на електрона в дадена област около ядрото. Този модел обяснява химическата връзка, спектроскопията и свойства на твърди тела.
Строеж на атома и основни понятия
Атомът се състои от компактно ядро и обвивка от електрони. Ядрото съдържа протони (положителен заряд) и неутрони (без електричен заряд). Броят протони определя атомния номер (Z) и химичния елемент; сумата от протони и неутрони дава масовото число (A). Изотопи са атоми на един и същи елемент с различен брой неутрони. Ако електроните са с по-малко или повече от броя протони, образуват се йони (позитивни или негативни).
В по-дълбок мащаб протоните и неутроните се състоят от кварки (в основата най-често up и down кварки), свързани чрез силното взаимодействие, носено от глюони. Електронът е фундаментална частица от семейството на лептоните и не се смята, че има вътрешна структура.
Ключови открития и експерименти
- Катодни лъчи — откриване на електрона и измерване на отношение заряд/масa.
- Експериментът със златно фолио — установява ядрената структура на атома.
- Спектроскопия и квантови постулати — обясняват дискретните линии в емисионните спектри.
- Откриването на неутрона — обяснява масовите и ядрените свойства на елементите.
- Експерименти в ускорители (дълбоко нееластично разсейване) — потвърждават вътрешната кваркова структура на нуклоните.
Приложения на атомната теория
- Обяснение на химични връзки и реактивност, основа на химията и химически технологии.
- Развитие на периодичната таблица и предсказване на свойства на елементите.
- Ядрена физика и енергетика — ядрените реакции, делене и синтез.
- Материалознание и полупроводници — електронната структура определя проводимостта и оптичните свойства.
- Медицински приложения — например радиоактивни изотопи в диагностика (ПЕТ) и терапия.
Ограничения и модерни въпроси
Атомната теория дава мощни и точни предсказания за много системи, но има условия, при които класическите или дори стандартните атомни модели трябва да се разширят:
- В плазмата и при екстремни температури/плътности атомите са ионизирани и поведението на заредените частици изисква плазмени модели.
- В неутронните звезди и при екстремни гравитационни условия материята преминава в състояния, в които ядрената физика и квантовата хромодинамика (QCD) диктуват свойствата.
- Съвместяването на квантовата механика с общата теория на относителността остава нерешен фундаментален въпрос при описанието на материя в екстремни условия.
Атомната теория е резултат от стотици години наблюдения и експерименти. Тя продължава да се развива, като всяко ново откритие — от микроскопичните свойства на електроните до поведението на кварките и силните взаимодействия — обогатява нашето разбиране за структурата на материята.

Демокрит е гръцки философ, 460 г. пр.н.е.

Роджър Джоузеф Боскович. Хърватски йезуит, който създава прототип на атомната теория

Джон Далтън (1766-1844), английски химик и физик
Сър Джоузеф Джон Томсън (1856-1940), английски физик, открива електрона и неговия отрицателен заряд. Той получава Нобелова награда за физика
Атомната теория на Демокрит
Демокрит смятал, че ако режеш нещо наполовина отново и отново, накрая ще трябва да спреш. Той казва, че последното парче материя не може да се намали повече. Демокрит наричал тези малки парчета материя атоми, което означава "неделим". Той смятал, че атомите са вечни, никога не се променят и не могат да бъдат унищожени. Демокрит смятал, че между атомите няма нищо и че всичко около нас може да се обясни, ако разберем как работят атомите.
Някои други философи се съгласяват, а други не. Те не са имали възможност да експериментират, за да покажат дали теорията му е вярна или не.
Атомната теория на Бошкович
През 1758 г. Роже Джоузеф Боскович описва предшественик на атомната теория.
Атомната теория на Далтън
През 1803 г. английският учен Джон Далтън, роден в Къмбърланд, преработва теорията на Демокрит по следния начин:
- Цялата материя се състои от атоми.
- Атомите са неделими и невидими частици.
- Атомите на един и същ елемент са от един и същи вид и маса.
- Атомите, от които се състоят химичните съединения, са в определени пропорции.
- Химичните промени са свързани с реорганизация на атомите, участващи в химичната реакция.
Далтън определя атома като основна единица на елемента, която може да участва в химично съединение.
Атомен модел на Томсън
През 1850 г. сър Уилям Крукс конструира "газоразрядна тръба", която представлява стъклена тръба с отстранен въздух и метални електроди в краищата, свързана към източник на високо напрежение. При създаване на вакуум в тръбата се наблюдава светъл разряд, който преминава от катода (отрицателно зареден електрод) към анода (положително зареден електрод). Крукс нарича това излъчване "катодни лъчи".
След експериментите с катодните лъчи сър Джоузеф Джон Томсън установява, че излъчваните лъчи се формират от отрицателни заряди, тъй като те се привличат от положителния полюс. Томсън знаел, че атомите са електрически неутрални, но установил, че за да се случи това, атомът трябва да има еднакво количество отрицателни и положителни заряди. Отрицателните заряди били наречени електрони (e-).
В съответствие с установените предположения за неутралния заряд на атомите Томсън предлага първия атомен модел, който е описан като положително заредена сфера, в която са инкрустирани електроните (с отрицателни заряди). Той е известен като модела на сливовия пудинг.
През 1906 г. Робърт Миликан определя, че електроните имат Кулонов заряд (C) от -1,6 * 10−19, което позволява да се изчисли масата им като малка, равна на 9,109 * 10 −31kg.
По същото време експериментите на Юджийн Голдщайн през 1886 г. с катодни разрядни тръби му позволяват да установи, че положителните заряди имат маса от 1,6726 * 10 −27kg и електрически заряд от +1,6 * 10 C−19. Лорд Ърнест Ръдърфорд по-късно нарича тези положително заредени частици протони

Схематично представяне на модела Thomson.
Атомен модел на Ръдърфорд
През 1910 г. новозеландският физик Ърнест Ръдърфорд изказва идеята, че положителните заряди на атома се намират предимно в центъра му, в ядрото, а електроните (е) - около него.
Ръдърфорд показва това, когато използва източник на алфа-радиация (от хелий), за да удари много тънки златни листове, заобиколени от абажур от цинков сулфид, който произвежда видима светлина, когато е ударен от алфа-радиацията. Този експеримент е наречен експеримент на Гайгер-Марсден или експеримент със златно фолио
До този момент са ясни основните елементи на атома, както и откритието, че атомите на даден елемент могат да се срещат в изотопи. Изотопите се различават по броя на неутроните в ядрото. Въпреки че този модел е бил добре разбран, съвременната физика се е развила още повече и съвременните идеи не могат да бъдат лесно разбрани. Някаква представа за съвременната атомна физика можете да намерите в линковете в таблицата по-долу.
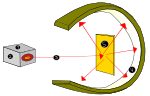
Атомен експеримент на лорд Ърнест Ръдърфорд
Съвременна физика
Атомите не са елементарни частици, тъй като са изградени от субатомни частици като протони и неутрони. Протоните и неутроните също не са елементарни частици, защото са съставени от още по-малки частици, наречени кварки, свързани помежду си с други частици, наречени глуони (защото те "слепват" кварките в атома). Кварките са елементарни частици, защото те не могат да бъдат разградени повече.
Въпроси и отговори
В: Какво представлява атомната теория?
О: Атомната теория обяснява как разбирането ни за атома се е променило с течение на времето.
В: Какво са представлявали някога атомите?
О: Някога се е смятало, че атомите са най-малките частици на материята.
В: От какво всъщност се състоят атомите?
О: Атомите се състоят от протони, неутрони и електрони.
В: От какво се състоят субатомните частици?
О: Субатомните частици се състоят от кварки.
Въпрос: Кой е гръцкият философ, който пръв стига до идеята за атома?
О: Първата идея за атома е на гръцкия философ Демокрит.
В: Кой е британският химик и физик, който допринася с много идеи за съвременната теория?
О: Джон Далтън, британски химик и физик, допринесъл с много идеи за съвременната теория.
Въпрос: Атомната теория важи ли за плазмата или неутронните звезди?
О: Теорията се прилага за твърди тела, течности и газове, но не се прилага по начин, аналогичен на плазмата или неутронните звезди.
обискирам