Моделът на сливовия пудинг: определение, Томсън и историческо значение
Моделът на сливовия пудинг на Дж. Дж. Томсън — дефиниция, историческо значение и влияние върху развитието на атомната теория.
Моделът на сливовия пудинг е ранен (и неправилен) модел на атома от 20-ти век. Той е предложен от Джей Джей Томсън през 1904 г., след откриването на електрона, но преди откриването на атомното ядро. По това време учените са знаели, че в атома има положителен заряд, който уравновесява отрицателните заряди на електроните, което прави атома неутрален, но не са знаели откъде идва положителният заряд. Моделът на Томсън показва атом, който има положително заредена среда или пространство, с отрицателно заредени електрони вътре в средата. Скоро след предлагането му моделът е наречен "модел на сливовия пудинг", тъй като положителната среда е като пудинг, с електрони или сливи вътре.
Какво представлява моделът
Моделът на сливовия пудинг представя атома като почти равномерно разпределена положителна матрица, в която са вградени отделни отрицателни частици — електроните. Положителната част е смятана за разпределен заряд (не отделни частици), който балансира отрицателните заряди и прави атома неутрален. Аналогията със сливовия пудинг има за цел да улесни визуализацията: "пудингът" е положителният заряд, "сливите" са електроните.
Джей Джей Томсън и доказателствата
Джей Джей Томсън (J. J. Thomson) откри електрона през 1897 г. чрез експерименти с катодни лъчи и измерване на отношение заряд-маса (e/m). След това, опитвайки се да съчетае новоткритата частица с тогавашните знания за електрическите свойства на атомите, той предложи модела с разпределена положителна материя. Моделът обясняваше защо атомът е електрически неутрален и защо електроните не „падат“ незабавно — идеята беше, че те са задържани в положителната среда.
Ограничения и експериментално опровергаване
- Моделът не може да обясни явления като дискретните спектрални линии на елементите (напр. лините на водорода).
- Не описва стабилността на електронните орбити по квантовите закони и не дава механизъм за енергетичните нива.
- Критично опровержение дойде от експериментите с разсейване на алфа-частици, проведени от Ханс Гайгер и Ърнест Марсден под ръководството на Ърнст Ръдърфорд (1909–1911). Те показаха, че значителна част от масата и положителният заряд са концентрирани в малко, плътно ядро — резултат, несъвместим с разпределената „пудинг“ положителна материя.
Последващи модели и историческо значение
Резултатите от експериментите на Ръдърфорд доведоха до предложението на ядрен модел на атома (1911), според който почти цялата маса и положителният заряд са в централно ядро, а електроните обикалят около него. По-късно Нилс Бор (1913) въведе квантови идеи за стабилни орбити и дискретни енергийни нива, което още по-ясно замени пластичния модел на Томсън.
Въпреки своите недостатъци, моделът на сливовия пудинг има важно историческо значение:
- Той е първият опит да се съчетаят новите открития за електрона с цялостна картина на атома.
- Послужи като междинна стъпка, която стимулира експерименти и нови теории.
- Илюстрира как научните модели се развиват — чрез предлагане, тестване и опровержение.
Основни характеристики (резюме)
- Период: началото на 20 век (предложен около 1904 г.).
- Автор: Джей Джей Томсън.
- Концепция: разпределена положителна матрица с вградени отрицателни електрони.
- Силни страни: обяснява електрическата неутралност; съвместим с откриването на електрона.
- Слабости: не обяснява спектрални линии, атомна структура при разсейване на лъчи и квантови явления.
Заключение
Моделът на сливовия пудинг е важна историческа стъпка в развитието на атомната физика. Той често се използва в учебни материали като пример за ранна хипотеза, която е частично вярна, но в крайна сметка е заменена от по-точни експериментално потвърдени модели. Процесът на неговото приемане и опровергаване показва как науката прогресира чрез непрекъснато съпоставяне на идеи с наблюдения.

Пример за модела на Томсън
Превръщане в модерен атомен модел
Моделът на Ръдърфорд
По принцип през 1909 г., малко след като е предложен моделът на Томсън, Ханс Гайгер и Ърнест Марсдън правят експеримент с тънки листове злато, за да проверят модела на Томсън. Техният професор Ърнест Ръдърфорд очаква резултатите да докажат правотата на Томсън, но резултатите се различават изключително много от очакванията им. През 1911 г. Ръдърфорд открива, че положителните заряди идват от миниатюрни частици, наречени протони, и че протоните се намират в малък център, наречен ядро, а електроните обикалят около ядрото.
Модел на Бор
Моделът на Ръдърфорд е доста прост, но е погрешен, защото електроните имат заряд и би трябвало да се привличат от положително зареденото ядро. През 1913 г. Нилс Бор добавя "енергийни нива" към атомния модел. Електроните не попадат в ядрото, защото се съдържат в енергийни нива, а за преминаването към по-високи енергийни нива е необходима допълнителна енергия, а за преминаването към по-ниски енергийни нива е необходимо освобождаване на енергия. Не е възможно да се променят енергийните състояния, без да се промени енергията на електрона. Ако електронът бъде ударен от фотон (частица, която пренася електромагнитно излъчване), той ще получи допълнителна енергия и ще премине в по-високо енергийно ниво (ще промени състоянието си), след което ще скочи обратно в по-ниско енергийно ниво, освобождавайки съдържащата се в него енергия. Този нов модел е наречен модел на Бор или модел на Ръдърфорд-Бор. Това добави цял нов клон на науката: Квантовата физика.
Квантов модел
През 1926 г. Ервин Шрьодингер използва идеята, че електроните действат като вълна, както и като частица, което е известно като дуализъм вълна-частица. Това добавя изцяло нов слой към атомния модел и квантовата физика. При една частица можете да разберете къде се намира в пространството, ако я наблюдавате (гледате). Но при вълната тя е навсякъде, така че не можете да определите къде точно се намира. Това е известно като квантова неопределеност. При електрона можете да знаете само вероятността той да се намира на дадено място, тъй като той е вълна, както и частица. (Вижте схемата по-горе)
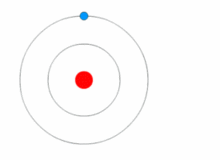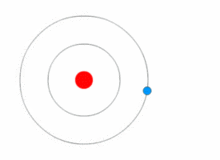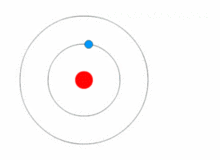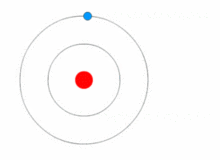
Картинка, показваща промяна на енергийното ниво на електрона, както и получаване и освобождаване на енергия под формата на фотони.
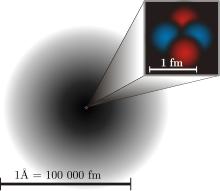
Това показва текущия атомен модел. Черното засенчване около атома показва вероятността да се намери електрон в него. Колкото по-тъмно е то, толкова по-голяма е вероятността да намерите електрон на това място.
Свързани страници
- Атомна теория
- Квантова механика
- J. J. Thomson
- Ърнест Ръдърфорд
- Нилс Бор
- Ервин Шрьодингер
обискирам