Периодична таблица на химичните елементи — строеж, групи и свойства
Пълно ръководство за периодичната таблица: строеж, периоди, групи и свойства на елементите с примери, модели и историята на Менделеев.
Периодичната таблица на химичните елементи е списък на известните химични елементи. В таблицата елементите са подредени по реда на атомните си номера, като се започне от най-малкия номер едно - водорода. Атомният номер на даден елемент е същият като броя на протоните в конкретното ядро на атома. В периодичната таблица елементите са подредени в периоди и групи. Един ред от елементи в таблицата се нарича период. Всеки период има номер; от 1 до 8. В период 1 има само 2 елемента: водород и хелий. Период 2 и период 3 имат по 8 елемента. Другите периоди са по-дълги. Елементите в един период имат последователни атомни номера.
Една колона от елементи надолу по таблицата се нарича група. В стандартната периодична таблица има 18 групи. Всяка група има номер: от 1 до 18. Елементите в една група имат електрони, подредени по сходен начин, според броя на валентните електрони, което им дава сходни химични свойства (държат се по сходен начин). Например група 18 е известна като благородни газове, защото всички те са газове и не се комбинират с други атоми.
Съществуват две системи за номерата на групите: едната използва арабски цифри (1,2,3), а другата - римски цифри (I, II, III). Названията с римски цифри се използват през по-голямата част от 20-ти век. През 1990 г. Международният съюз по чиста и приложна химия (IUPAC) решава да използва новата система с арабски цифри, която да замени двете стари системи за групи, използващи римски цифри.
Периодичната таблица се използва от химиците за наблюдение на моделите и връзките между елементите. Периодичната таблица има три основни групи: метали, металоиди и неметали. Например, елементите в долната и крайната лява част на таблицата са най-металните, а елементите в горната дясна част са най-малко металните. (напр. цезият е много по-метален от хелия). Съществуват и много други закономерности и връзки.
Периодичната таблица е изобретена от руския химик Дмитрий ИвановичМенделеев (1834-1907). В негова чест елемент 101 е наречен на негово име - менделеев.
Строеж на таблицата и електронни конфигурации
Всеки елемент в таблицата се определя от своя атомен номер (броя протони). Разположението по периоди отразява попълването на електронните обвивки — основният квантов номер (n) определя периода, а вида на попълващата се орбитална подобласт (s, p, d, f) определя блока на таблицата. Така говорим за:
- s-блок (групи 1–2 и водород/хелий) — тук се попълва s-орбиталата;
- p-блок (групи 13–18) — пълнене на p-обвивката;
- d-блок (переходни метали, групи 3–12) — пълнене на d-орбиталата;
- f-блок (лантаниди и актиниди) — пълнене на f-орбиталите; тези елементи често се поставят отделно в долната част на таблицата.
Електронната конфигурация определя химичните свойства — броят и разположението на валентните електрони (външните електрони) влияят върху способността на атома да свързва електрони и да образува химични връзки.
Групи с характерни свойства (примери)
- Група 1 — алкални метали: силно реактивни, един валентен електрон, лесно губят електрон и образуват +1 йони.
- Група 2 — алкалоземни метали: по-малко реактивни от алкалните, имат два валентни електрона и образуват +2 йони.
- Група 17 — халогени: неметали с 7 валентни електрона, силно предпочитат да приемат един електрон и образуват −1 йони; включват флуор, хлор и др.
- Група 18 — благородни газове: почти инертни при стандартни условия поради запълнени валентни обвивки (изключения: някои ксенонови съединения могат да се образуват при специални условия).
- Преходни метали: характерни с променливи оксидационни състояния, добри проводници на топлина и електричество, често използвани в индустрията и катализата.
Периодични тенденции
Някои от най-важните закономерности, които наблюдаваме в таблицата:
- Атомен радиус: нараства надолу в група (повече електронни обвивки) и намалява отляво надясно в период (по-голям ядрен заряд притегля електроните по-силно).
- Енергия на йонизация: енергията, нужна за отнемане на електрон; намалява надолу по група и нараства отляво надясно.
- Електроотрицателност: склонността да привличаш електрони в химична връзка; общо взето нараства отляво надясно и нагоре.
- Металност: нараства надолу и наляво; елементите в долния ляв ъгъл са най-метални.
Лантаниди, актиниди и синтетични елементи
Лантанидите и актинидите образуват f-блока и често са отделени в таблицата. Елементите с атомни номера над 92 (уран) са главно синтетични и радиоактивни; някои се получават само в лабораторни условия. Към момента са потвърдени елементи до атомен номер 118 (Oganesson), а изследванията продължават.
История и значение
Периодичният закон — че свойствата на елементите са периодична функция на техните атомни номера — е формулиран и илюстриран от руския химик Дмитрий ИвановичМенделеев (1834-1907). Менделеев наредил елементите по маса и оставил празни места за още неизвестни елементи, предсказвайки техните свойства; по-късно много от тези елементи били открити и съответствали на прогнозите му. Мodерната таблица се основава на атомни номера и електронни конфигурации.
Номенклатура и варианти на таблицата
Съществуват малки вариации в начина на представяне (например различни графични оформления, таблици с цветово кодиране по категории, и др.). IUPAC утвърждава стандартната нумерация на групите (1–18), но старите системи с римски цифри и A/B означения все още се срещат в учебници и публикации.
Практически приложения
Периодичната таблица е инструмент, който позволява да се предвидят химични реакции, стабилност на съединения, видове връзки и оксидационни състояния. Тя е основен справочник за химиците, физиците, биолозите, инженерите и всички, които работят с материали и реактиви.
Кратко обобщение: Периодичната таблица обединява огромно количество информация за елементите по подреден и предвидим начин — чрез атомния номер, електронната конфигурация и закономерностите в свойствата им. Разбирането ѝ улеснява изучаването и приложението на химията във всички нейни области.
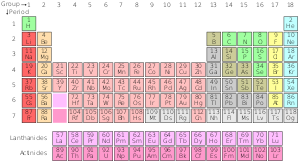
Стандартното изменение на периодичната таблица
Стандартна периодична таблица
| Група→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 12 | 13 | 14 | 15 | 16 | 17 | ||||
| 1 | 2 | |||||||||||||||||||
| 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||||||||||||
| 3 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||
| 4 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | ||
| 5 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | ||
| 6 | 55 | 56 | * Лантаниди | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 | 81 | 82 | 83 | 84 | 85 | 86 | ||
| 7 | 87 Fr | 88 | ** Актиниди | 104 | 105 | 106 | 107 | 108 | 109 | 110 | 111 | 112 | 113 | 114 | 115 | 116 | 117 | 118 | ||
| 8 | 119 Uue | 120 Ubn | *** Суперактиниди | |||||||||||||||||
| * Серия лантаниди | 57 | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 | |||||
| ** Серия актиниди | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 | |||||
| *** Серия суперактиниди | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129Ube | 130Utn | 131Utu | 132Utb | 133Utt | 134Utq | 135Utp | |||||
| *** Серия суперактиниди | 136Uth | 137Uts | 138Uto | 139Ute | 140Uqn | 141Uqu | 142Uqb | 143Uqt | 144Uqq | 145Uqp | 146Uqh | 147Uqs | 148Uqo | 149Uqe | 150Upn | |||||
| *** Серия суперактиниди | 151Upu | 152Upb | 153Upt | 154Upq | 155Upp | 156Uph | 157Ups | 158Upo | 159Upe | 160Uhn | 161Uhu | 162Uhb | 163Uht | 164Uhq | 165Uhp | |||||
| *** Серия суперактиниди | 166Uhh | 167Uhs | 168Ухо | 169Uhe | 170Usn | 171Usu | 172Usb | 173Ust | 174Usq | 175Usp | 176Ush | 177Uss | 178Uso | 179Използвайте | 180Uon | |||||
| *** Серия суперактиниди | 181Уу | 182Uob | 183Uot | 184Uoq | 185Uop | 186Uoh | 187Uos | 188Uoo | 189Uoe | 190Uen | 191Ueu | 192Ueb | 193Uet | 194Ueq | 195Uep | |||||
| *** Серия суперактиниди | 196Ueh | 197Ues | 198Ueo | 199Uee | 200Bnn | 201Bnu | 202Bnb | 203Bnt | 204Bnq | 205Bnp | 206Bnh | 207Bns | 208Bno | 209Bne | 210Bun | |||||
| *** Серия суперактиниди | 211Buu | 212Bub | 213Но | 214Buq | 215Bup | 216Buh | 217Bus | 218Buo | 219Bue | 220 млрд. | 221Bbu | 222Bbb | 223Bbt | 224Bbq | 225Bbp | |||||
Химични серии на периодичната таблица
- Алкални метали
- Алкални земни елементи
- Лантаниди
- Актиниди
- Суперактиниди
- Преходни метали
- Лоши метали
- Неметали
- Халогени
Състояние при стандартна температура и налягане. Цветът на числото (атомния номер) над символа на елемента показва състоянието на елемента при нормални условия.
- тези в синьо са газове
- тези в зелено са течности.
- тези в черно са твърди
- Тези с плътни граници имат стабилни изотопи (първични елементи).
- В тези с прекъснати граници има само радиоактивни изотопи, срещащи се в природата.
- Тези с пунктир не се срещат в природата (синтетични елементи).
- тези, които нямат граници, са твърде радиоактивни, за да бъдат открити досега.
Други методи за изобразяване на химичните елементи
Показаната по-горе версия на периодичната таблица е най-използваната. Други широко разпространени версии са показани по-долу:
· 
Теодор Бенфей подрежда елементите в спирала около водорода. Атомното тегло определя позицията на елемента.
· 
Дмитрий Иванович Менделеев използва подредба на цветя; актинидите и лантанидите са показани като примки до основната група.
· 
Тимъти Стоув подрежда елементите по квантов номер.
· ![]()
Беттерман подреди елементите по техните изоелектрични свойства, които могат да се преобразуват в полиномна форма.
· 
Триъгълна версия от Zmaczynski и Bayley
· 
Подредени в пирамида.
Версии, използвани по-малко
- Стандартната таблица съдържа основните данни. Тя е показана по-горе
- Вертикална таблица за по-добра четливост в уеб браузърите
- Голямата таблица съдържа основните данни и пълните имена на елементите
- Огромната таблица съдържа основните данни, както и пълните имена на елементите и атомните маси.
- Електронни конфигурации
- Метали и неметали
- Списък на елементите: включва име, символ, атомен номер, атомна маса, група и период; може да се подрежда по всеки от тези елементи
- Списък на елементите по символ
- Списък на елементите по температура на кипене
- Списък на елементите по температура на топене
- Списък на елементите по плътност
Свързани страници
- Група от периодичната таблица
- Период на периодичната таблица
- Разширена периодична таблица
Въпроси и отговори
Въпрос: Какво представлява периодичната таблица?
О: Периодичната таблица е диаграма, която подрежда всички известни химични елементи по реда на техните атомни номера, като започва с водорода под номер едно. Елементи със сходни характеристики често се поставят близо един до друг.
В: Колко периода и групи има в стандартната периодична таблица?
О: В стандартната периодична таблица има 8 периода и 18 групи.
В: Какво е общото между елементите в един период?
О: Елементите в един период имат последователни атомни номера.
В: Какво е общото между елементите в група?
О: Електроните на елементите в една група са разположени по подобен начин, според броя на валентните електрони, което им придава сходни химични свойства.
В: Кой е измислил периодичната таблица?
О: Периодичната таблица е изобретена от руския химик Дмитрий Иванович Менделеев (1834-1907 г.).
В: Кои са трите основни групи в периодичната таблица?
О: Трите основни групи в Периодичната таблица са метали, металоиди и неметали.
В: Как могат да се наблюдават закономерности и връзки между елементите, като се използва Периодичната таблица?
О: Моделите и връзките между елементите могат да се наблюдават, като се погледне къде се намират в Периодичната таблица; например елементите долу вляво от нея са по-скоро метални, отколкото тези горе вдясно.
обискирам