Алкини (ацетилени): тройна връзка, строеж, свойства и реакции
Практичен обзор на алкините (ацетилени): строеж, тройна връзка, физико-химични свойства и ключови реакции с примери и приложение в органичната химия.
Алкинът е молекула, която съдържа тройна връзка между два въглеродни атома. Общата формула на ненаситените алкини е CnH2n-2. Често се наричат и ацетилени. Най-малкият и най-прост представител е ацетиленът (етин) — не бива да се бърка с етилена (етен). Алкините са предимно хидрофобни: разтварят се добре в органични разтворители, но лошо във вода. Всеки следващ член от хомоложния ред се получава чрез прикачване на звено "-CH"2, т.е. молекулната формула расте с това звено.
Строеж и характера на тройната връзка
Тройната връзка между двата въглерода се състои от една σ‑връзка и две π‑връзки. В резултат на това въглеродните атоми имат sp‑хибридизация и линейна геометрия около тройната връзка (ъгъл при C–C–C ≈ 180°). Поради по-големия s‑характер на sp‑орбиталата, свързаният с тройната връзка въглерод притежава по‑голяма електронегативност и дължи по‑силно привличане на свързания протон — това обяснява относителната киселинност на терминалните алкини (pKa около 25).
Физични свойства
- Нискополярни, предимно неполярни молекули; малко разтворими във вода, добре разтворими в органични разтворители.
- Точките на кипене и топене нарастват с увеличаване на молекулната маса; тенденцията е подобна на другите въглеводороди, но структурата (линейност) влияе върху взаимодействията.
- Дължината на C≡C е по‑къса от C=C и C–C, а енергията на връзката е по‑висока при тройната връзка.
Химични свойства и типични реакции
Алкините са по‑реактивни от наситените въглеводороди и в много случаи по‑реактивни от алкените. Основни класове реакции и примери:
- Де‑протониране на терминален алкин — с много силни основи (например NaNH2) се отстранява терминалният протон и се образува ацетилиден анион (ацетилид), който е силен нуклеофил и се използва за образуване на нови C–C връзки чрез нуклеофилно заместване на първични алкилхалиди.
- Добавяне (аддиции) — алкините дават реакции на аддиция към тройната връзка:
- Хидрогениране: пълно (H2/Pd) → алкани; частично с отровен катализатор (Lindlar) → цис-алкени; с разтворим метал/амоняк (Na/NH3) → транс-алкени.
- Халогениране и хидрохалогениране: водят първо до винилни, после до ди‑халогенни продукти (в зависимост от условията).
- Хидратация: при Hg(II)-катализирана хидратация терминалните алкини дават главно кетони (марковниково), а при хидробориране‑окисление може да се получат алдехиди (анти‑марковниково за терминални алкини).
- Редукции — алкините лесно се редуцират до двойни връзки или до алкани; избирателността (цис/транс) зависи от условията, както отбелязано по‑горе.
- Нуклеофилни реакции и изграждане на въглерод‑въглеродни връзки — ацетилидните аниони участват в реакции с алкилхалиди (SN2) и са важни инструменти в органичния синтез за удължаване на въглеродни скелети.
- Метал‑катализирани реакции — Sonogashira‑присъединяване позволява свързване на терминални алкини с арилни или винилни халиди (образуване на въглерод‑въглеродни връзки при Pd/Cu катализа).
- Перициклични реакции — алкините участват в перицикличните реакции, напр. [2+2+2] циклополимеризации, 1,3‑диелектрични присъединявания и други реакционни типове, които използват техния π‑системен характер.
Практическо значение и безопасност
- Алкините (особено ацетиленът) са важни изходни вещества в органичната синтеза: използват се за изграждане на въглеродни рамки, при производство на фармацевтични междинни продукти и функционални материали.
- Ацетиленът се използва и като гориво за заваряване (в комбинация с кислород) и като химически реагент; обаче се съхранява под специални условия, тъй като може да е нестабилен и експлозивен при компресия или в присъствието на някои метали.
- Безопасност: алкините са силно запалими; при работа с ацетилени и реактивни интермедиати се налагат подходящи мерки — вентилация, изолация от искри, използване на одобрени бутилки и катализатори, както и контрол на температурите.
В обобщение, алкините (ацетилените) са линейни въглеводороди с тройна връзка, които комбинират относителна стабилност на σ‑връзката с висока реактивност на π‑системата. Това ги прави изключително полезни във фундаменталната и приложната органична химия.
Структура
Алкините имат ъгъл от 180 градуса между двата въглеродни атома. Поради тази причина те не обичат да бъдат в циклични съединения. Някои примери за алкини са показани по-долу.
| Функционални групи |
|
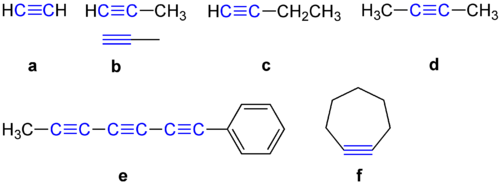
Примери за алкини
Въпроси и отговори
В: Какво представлява алкинът?
О: Алкинът е молекула, която има тройна връзка между два въглеродни атома.
В: Каква е общата формула на алкините?
О: Общата формула на алкините е CnH2n-2.
В: Кой е най-малкият алкин?
О: Най-малкият алкин е ацетиленът, наричан още етилен.
В: Алкините са хидрофобни или хидрофилни?
О: Алкините са хидрофобни, което означава, че се разтварят добре в органични разтворители, но не и във вода.
В: По какво се различава всеки следващ член на алкина един от друг?
О: Всеки следващ член на алкина се различава по молекулната си формалност с "-CH2".
В: Алкините по-реактивни ли са от обикновените въглеводороди?
О: Да, алкините са по-реактивни от обичайните въглеводороди, като например алкените, в много реакции.
В: Какво може да се направи с алкин в края на молекулата?
О: Ако алкинът се намира в края на молекулата, той може лесно да се отстрани чрез протониране със силна основа и след това да се използва в реакции на добавяне, например като се добави към кетон.
обискирам