Тиал (тиоалдехид): определение, свойства и реактивност
Тиал (тиоалдехид): дефиниция, свойства и висока реактивност — разберете структурата, електрофилността и как обемисти R групи стабилизират тези съединения.
Тиал или тиоалдехид е всяка молекула с група RC(S)H. Това е роднина на алдехид, при която кислородният атом е заменен със сяра и въглеродно–сярната връзка има двойна връзка между въглерода и сярата. Сярата носи две самотни двойки, което допълнително определя електронната структура и реактивността на молекулата.
Основни свойства
Сравнено с обикновените алдехиди, тиалите имат няколко характерни особености:
- Поради по-големия атом на сярата и по-слабата pπ–pπ припокриваност C=S връзката е по-дълга и по-поляризируема от C=O. Това ги прави по-електрофилни и обикновено по-реактивни.
- Много тиали и тиокетони имат интензивни цветове (в сравнение с безцветните повечето карбонили), тъй като преходите n→π* и π→π* за C=S са в различен енергиен диапазон.
- В спектроскопията C=S дава характерни сигнали — отличимо поглъщане в ИЧ спектъра и специфични химични сдвиги в 13C NMR — което улеснява идентификацията им в разтвори и смесени среди.
Стабилност и получаване
Тиалите са по-малко стабилни от техните кислородсъдържащи аналози. Малките заместващи групи (особено H) не предпазват реактивния тиален въглерод, затова тези съединения често:
- димеризират или полимеризират
- реагират бързо с нуклеофили или с други молекули от същия вид
Поради това простите тиали обикновено се получават и използват „in situ“ или се стабилизират чрез стерични (обемисти) и/или електронодонорни/приемни заместители. Често използвани методи за превръщане на карбонили в тиокарбонили включват реагенти като Lawesson reagent или P4S10 (фосфорен пентасулфид), които заместват O със S в C=O.
Реактивност
Тиалите са силни електрофили и участват в множество типични трансформации:
- Нуклеофилни адции към C=S (аналогично на карбонилите), често по-бързо и по-лесно за провеждане.
- Бързи циклоадицни реакции — например реакции на Диелс-Алдер с подходящи диени — при които C=S служи като активен диноприемник и дава достъп до разнообразни серносъдържащи циклични системи.
- Димеризация/полимеризация и други странични процеси при непредпазени тиали; затова употребата им често изисква ниски температури, инертна атмосфера и/или стерични заместители.
Стабилизиране и отличия
Ако атомът H върху тиалния въглерод бъде заместен с органична R група, полученият вид се нарича тиокетон. Тиокетоните (R–C(=S)–R') обикновено са по-стабилни от тиалите — частично поради липсата на реакционноспособния квартен въглерод-водород и често заради възможността за конюгация или стерично защитаване на C=S групата. Обемисти (sterically hindered) заместители също забавят нежеланите странични реакции и позволяват изолация и съхранение на такива тиокарбонили.
Приложения и безопасност
Тиалите и тиокетоните намират приложение като междинни съединения в органичния синтез — за изграждане на сулфурсъдържащи хетероцикли, за целеви циклоадични реакции и като активни функционални групи в многокомпонентни синтези. Поради присъствието на сяра и високата реактивност, работата с тези вещества често изисква мерки за безопасност: работа под инертна атмосфера, контролирана температура и подходяща вентилация (някои тиосъединения имат неприятна миризма и могат да бъдат дразнещи).
В обобщение: тиалите (тиоалдехиди) са важна, но реактивна група в органичната химия — показват повишена електрофилност и склонност към циклоадикции и полимеризация, докато превръщането им в тиокетони или използването на обемисти заместители може значително да повиши стабилността и приложимостта им.
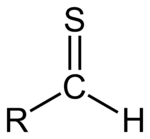
Обща структура на тиал
обискирам