Самотна двойка — определение, свойства и роля във формата на молекулите
Научете какво е самотна двойка, нейното влияние върху форма и свойства на молекулите, ролята в реакциите и примери за нуклеофили — ясно и достъпно обяснение.
Самотната двойка е група от два електрона, които не участват във връзки между атомите. Те се намират в последната електронна обвивка на атома — в валентната обвивка, и заедно с електроните, които образуват връзки, определят общия брой валентни електрони. Самотните двойки често имат по-висока енергия от електроните, участващи в свързване, но обикновено са с по-ниска енергия от анти-свързващите орбитали.
Какво може да прави самотната двойка
Самотната двойка може да образува нови връзки, като бъде дарител на електронна плътност към друг атом или център. Това прави атома с такава двойка по-склонен да действа като нуклеофил или като Луисова база. Например, Нуклеофилите често използват самотни двойки, за да атакуват електрофилни центрове; по този начин се започват реакции, при които се образуват нови химични връзки. Самотните двойки също участват в координационни връзки към метали, образувайки донорно-акцепторни (координационни) връзки.
Влияние върху формата на молекулата
Самотните двойки силно влияят на геометрията на молекулите. По правилото VSEPR (валентна електронна двойка — оттлъскване на валентните електронни двойки), неподелени електронни двойки заемат повече пространствен обем около атома, отколкото свързващите електронни двойки. В резултат на това ъглите между връзките могат да се стесняват.
- Примери: в тетраедричната геометрия базов ъгъл е 109.5° (CH4), но за NH3 (една самотна двойка) ъгълът между връзките е около 107°, а за H2O (две самотни двойки) — около 104.5°.
- Самотните двойки на един и същи атом се отблъскват една от друга и се разполагат възможно най-далече, за да минимизират отблъскването.
Хибридизация и делокализация
Разположението и естеството на самотната двойка зависи от хибридизацията на атома. Например самотна двойка върху sp3-хибридизиран азот (какъвто е в NH3) е относително локализирана; ако обаче самотната двойка е делокализирана в ароматна или конюгирана система (напр. анилин или амидни групи), тя може да има sp2-характер и да участва в резонанс. Делокализацията намалява основността и реактивността на самотната двойка, но увеличава стабилността на молекулата.
Химични и физични свойства, свързани със самотните двойки
- Базичност и нуклеофилност: наличието и разположението на самотната двойка определя колко лесно атомът може да приеме протон или да атакува електрофил.
- Водородни връзки: самотните двойки на кислород и азот образуват водородни връзки с H-носители, което влияе на точките на кипене, разтворимостта и структурата на съединения.
- Спектроскопия: самотните двойки участват в n→π* или n→σ* преходи, които могат да бъдат наблюдавани в UV–Vis спектрите и да влияят на IR честотите.
- Реакционна селективност: локализацията или делокализацията на самотната двойка определя кои позиции в молекулата са по-реактивни.
Чести примери
- Кислород в H2O — два чифта самотни електрони; голям ефект върху ъгъла и полярността.
- Азот в NH3 — един самотен електронен чифт; дава основни и нуклеофилни свойства.
- Халогениди (Cl−, Br−) — имат по няколко самотни двойки, правещи ги силни нуклеофили и добри донори на електронна плътност.
Практически значение: Самотните двойки определят много от свойствата на веществата — форма, полярност, реактивност, способност за образуване на водородни и координационни връзки. Разбирането на тяхното поведение е ключово за предсказване на структурата и реакциите на молекулите.
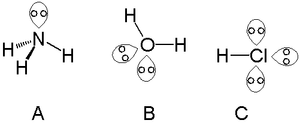
Самотни двойки в амоняк (A), вода (B) и солна киселина (C)
обискирам