Електрофил — определение, свойства и примери в органичната химия
Електрофил — ясно определение, ключови свойства и ясни примери в органичната химия. Разберете ролята им в реакции, механизми и практични приложения.
В химията електрофил е молекула или атом, който с удоволствие приема електрони от друг. Много електрофили имат положителен заряд. Те се наричат още киселини на Луис. Някои примери за електрофили са молекули, в които атомите имат голяма разлика в електроотрицателността, като HCl или карбонил, а също и окислители.
Електрофилите се атакуват от нуклеофил, който е противоположният вид молекула. Това се случва например при реакциите на добавяне.
Какво е електрофил — просто обяснение
Електрофил е химически вид (атом, йон или молекула), който търси електронна плътност — т.е. може да приеме една или повече електронни двойки. В общия случай електрофилите са киселини на Луис (приемат електронни двойки), но не винаги носят формален положителен заряд; често са неутрални, но поляризирани (имат частичен положителен заряд върху определен атом).
Основни свойства, които определят електрофилността
- Формален заряд: катионите (напр. R+) обикновено са силни електрофили.
- Поляризация: в полярни везикли или среди атом с голяма електроотрицателност кара другия атом да стане частично положителен (напр. в карбонилната група C=O).
- Ниско разположено LUMO: молекулите, чиито най-ниско незапълнени орбитали (LUMO) имат ниска енергия, лесно приемат електронна плътност.
- Резонанс и стабилизация: ако образуваният положителен център може да се делокализира чрез резонанс, това влияе върху реактивността и стабилността на електрофила.
- Хибридизация: sp2-струкуриран въглерод (като в карбонил) е по-електрофилен от sp3 аналог, защото е по-достъпен и по-положителен.
- Влияние на заместители: електрон-оттеглящи групи увеличават електрофилността; електрон-даряващи групи я намаляват.
- Солвент и температура: полярни и протични среди могат да стабилизират заряди и да променят скоростта на атакуване от нуклеофили.
- ХАРД/СОФТ (HSAB): "твърдите" електрофили предпочитат "твърди" нуклеофили (по-малки, по-заредени), а "меки" електрофили — меки нуклеофили.
Чести примери на електрофили в органичната химия
- Протони (H+) — най-простият електрофил, участват в протониране на алкени и карбонили.
- Карбокатиони (R+) — реакционно-способни междинни продукти в много реакции на алкилиране и изомеризация.
- Карбонилен въглерод (C=O) — електрофилен поради полярността на C=O; нуклеофилите атакуват карбонилния въглерод (напр. в нуклеофилно присъединяване към алдехиди и кетони).
- Ацилиеви йони (RCO+), нитрониев йон (NO2+), халониеви видове (Br+, Cl+) — участват в ацилиране, нитриране, халогениране и др.
- Диациони и сулфониеви центрове — важни при специфични механизми и трансформации.
Типични реакции, в които участват електрофили
Електрофилните центрове са ключови за множество органични механизми. Някои от най-често срещаните са:
- Електрофилно добавяне към алкени: електрофилът (напр. H+) атакува двойната връзка, след което нуклеофилът се свързва към образувания катионен интермедиат.
- Електрофилно ароматно заместване (EAS): когато арилови системи (арен) са атакувани от силен електрофил (NO2+, SO3, RCO+ и др.), първо се образува σ-комплекс, след което се възстановява ароматичността чрез елиминиране на протон. Примери: нитриране, сулфониране, халогениране, Friedel–Crafts алкилиране/ацилиране.
- Нуклеофилно присъединяване към карбонили: нуклеофилът атакува електрофилния карбонил, което води до образуване на допълнителни продукти (алкохоли, ацетали и т.н.).
Механистични бележки
При повечето електрофилни реакции скоростопределящата стъпка е атаката на субстрата от електрофила или образуването на электрофил-нуклеофилен комплекс. Регио- и стереоселективността се определят от стабилността на междинните продукти (напр. карбокатиони), стереоелектронни ефекти и влиянието на заместители.
Количествено измерване
Електрофилността може да се характеризира както кинетично (реактивни скорости), така и термодинамично (стабилност на междинните продукти). В теоретичната химия съществува и електрофилен индекс (ω) на Parr, базиран на химичния потенциал и твърдост, който дава числена оценка на склонността на вид да приема електрони.
Кратко резюме
Електрофилите са видове, които търсят електронна плътност и приемат електронни двойки. Те могат да бъдат йони, поляризирани молекули или неутрални видове с нискоенергичен LUMO. Разбирането на факторите, които влияят на електрофилността—заряд, резонанс, електроотрицателност, среда и заместители—е ключово за предвиждане и контрол на органичните реакции като електрофилно ароматно заместване, добавяне към алкени и нуклеофилно присъединяване към карбонили.
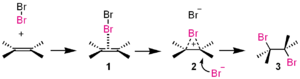
В тази реакция на добавяне бромът (Br2 ) е електрофил.
Въпроси и отговори
В: Какво е електрофил?
О: Електрофил е молекула или атом, който с удоволствие приема електрони от друга молекула или атом.
Въпрос: Защо електрофилите се наричат още киселини на Луис?
О: Електрофилите се наричат още киселини на Луис, защото могат да приемат двойки електрони от други молекули.
В: Кои са някои примери за електрофили?
О: Някои примери за електрофили са молекули, в които атомите имат голяма разлика в електроотрицателността, като HCl или карбонил, а също и окислители.
В: Как реагират нуклеофилите с електрофилите?
О: Нуклеофилите реагират с електрофилите, като ги атакуват.
В: Какво представлява нуклеофилът?
О: Нуклеофилът е противоположна молекула на електрофила. Това е молекула или атом, който с удоволствие отдава електрони.
Въпрос: Как протичат реакциите на добавяне между електрофили и нуклеофили?
О: Реакциите на добавяне протичат между електрофили и нуклеофили, когато нуклеофилът атакува електрофила, образувайки нова връзка.
В: Може ли електрофилът да има отрицателен заряд?
О: Електрофилът може да има положителен заряд, но може да има и частичен положителен заряд или да няма никакъв заряд. Основната характеристика е, че той е готов да приема електрони.
обискирам