Аддиция (реакция на добавяне) в органичната химия — видове и примери
Разберете аддицията в органичната химия: механизъм, нуклеофилно/електрофилно поведение, видове и ключови примери (хидратация, нуклеофилна атака на карбонили).
В органичната химия реакцията на добавяне се случва, когато две молекули се съединяват, за да създадат по-голяма. Това може да се случи само когато една от молекулите вече има двойна или тройна връзка. Това могат да бъдат връзки въглерод-въглерод или дори въглерод-кислород, въглерод-азот и други. Едната от двете молекули се нарича нуклеофил и тя е тази, която дава електрони на другата, за да се създаде новата връзка. Другата молекула се нарича електрофил и тя е тази, която получава електроните.
Реакцията на добавяне е противоположна на реакцията на елиминиране. Често срещани примери за реакции на добавяне са добавянето на вода през двойна връзка и нуклеофилната атака на карбонил.
Основни видове реакции на добавяне
- Електрофилно добавяне — характерно за алкени и алкини. Реагиращата двойна или тройна връзка действа като нуклеофил и атакува електрофил, образува се интермедиат (карбокатион или халониев йон), след което следва атака от нуклеофил. Примери: халогениране (Br2 към алкен), хидрохалогениране (HBr), хидратация (H2O/H+).
- Нуклеофилно добавяне — типично за карбонилни съединения (алдехиди, кетони). Нуклеофилът атакува електрофилния въглерод на карбонила и образува алкохолни производни или други аддукти. Примери: добавяне на цианид (образуване на цианохидрини), хидридно добавяне (NaBH4, LiAlH4), реакция с органомагнезиеви реагенти (Grignard) за получаване на спирти.
- Радикално добавяне — протича чрез радикални интермедиати; важен в полимеризацията на алкени (например получаване на полиетилен) и в специфични анти-Марковникови реакциите (например добавяне на HBr в присъствие на пероксиди).
- Цикло-добавяне (перициклични реакции) — включва едновременно образование на връзки в затворен цикъл; най-известният пример е реакцията на Дилс–Алдер (1,3-диен + алкен → циклохексанов дериват).
- Конюгирано (1,4) добавяне / Михелова добавка — при α,β-ненаситени карбонилни системи нуклеофилът може да добави в 1,2-позиция (директно към карбонила) или в 1,4-позиция (конюгирано), което дава различни продукти.
Регио- и стереоспецифичност
- Марковниково правило: при асиметрично разположени алкени протонът (или друг електрофил) се добавя там, където оформя по-стабилен карбокатион — това определя региоизомера в хидрохалогенирането и хидратацията. Съществуват обаче изключения (например хидробориране-окисление дава anti‑Markovnikov продукт).
- Стереохимия: добавянето може да бъде syn (и двете нови заместника се добавят от една и съща страна на двойната връзка) или anti (от противоположни страни). Например хидрогенирането с катализатор обикновено е syn, а халогенните добавяния чрез бромониев интермедиат са anti.
Типични механизми — кратко обяснение
- Електрофилно добавяне към алкен: първо електрофилът атакува двойната връзка и образува положителен интермедиат (карбокатион или бромониев йон), после нуклеофилът атакува интермедиата и се получава крайният продукт.
- Нуклеофилно добавяне към карбонил: нуклеофилът донор-електронова двойка атакува карбонилния въглерод; след protonation или последващи стъпки се получават спирти, хемиацетали, цианохидрини и др.
- Радикално добавяне: инициатор образува радикал, който атакува двойната връзка, следват верижни стъпки на растеж и терминиране (основата на свободнорадикалната полимеризация).
Практически примери и важни реакции
- Хидрогениране: добавяне на H2 към алкен с катализатор (Pd/C, Pt, Ni) → алкан (син‑аддукция на водородите).
- Халогениране: Br2 или Cl2 към алкен → 1,2‑дихалогенов алкан (обикновено anti добавяне чрез халониев йон).
- Хидрохалогениране: HBr/HCl към алкени → бром/хлор добавяне според Марковниково правило; в присъствие на пероксиди може да се получи anti‑Markovnikov продукт (радикален механизъм).
- Хидратация: киселинно-катализирана добавка на H2O към алкен → алкохол; алтернативи: оксимеркурация‑демеркурация (без ребукализация) или хидробориране‑окисление (anti‑Markovnikov, syn).
- Добавяне към карбонили: NaBH4 / LiAlH4 (редукция до алкохоли); RMgX (Grignard) дава след работа с вода — вторични/третични спирти.
- Формиране на защитни групи и интермедиати: образуване на хемиацетали/ацетали (при присъствие на алкохоли и киселина), иминогени (взаимодействие с амини) и други аддукти на карбонила.
- Дилс–Алдер: [4+2] циклоаддене между 1,3-диен и ен (или енолизаме) → синтетично ценен метод за създаване на циклични системи с висока стереоспецифичност.
Значение и приложения
Реакциите на добавяне са фундаментални в синтезата на органични вещества, полимери и фармацевтични молекули. Те позволяват селективно въвеждане на функционални групи, трансформиране на ненаситени системи и изграждане на сложни скелети чрез контрол върху регио- и стереохимията. Примери за приложения: производство на полиетилен и полипропилен (полимеризация чрез радикално или йонично добавяне), синтез на алкохоли и аминокиселини чрез нуклеофилна атака на карбонили, и множество крайни стъпки в синтезата на природни продукти и активни фармацевтични съставки.
Практически бележки за експерименти
- Контролът върху кислород, влага и температура често е критичен (особено за органометалически и радикални реакции).
- Изборът на реагенти и катализатор определя регио- и стереоизхода (например BH3 за anti‑Markovnikov хидратация без карбокатионни междинни продукти).
- При работа с опасни реагенти (Br2, HBr, LiAlH4, органометалически съединения) е задължително използване на подходяща защита и добри лабораторни практики.
Обобщено, реакциите на добавяне обхващат широк клас трансформации, от класическото електрофилно добавяне към алкени до сложни перициклични и нуклеофилни добавки към карбонили. Разбирането на механизмите и факторите, които определят регио‑ и стереоспецифичността, е ключово за успешното им приложение в синтетичната химия.
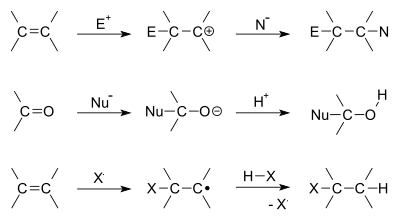
Някои примери за реакции на добавяне
Въпроси и отговори
В: Какво представлява реакцията на добавяне в органичната химия?
О: Реакция на добавяне е, когато две молекули се комбинират, за да образуват по-голяма молекула, и може да се случи само ако една от молекулите има двойна или тройна връзка.
В: При кои видове връзки може да има реакции на добавяне?
О: Връзките въглерод-въглерод, въглерод-кислород, въглерод-азот и други могат да имат реакции на добавяне.
В: Какво представлява нуклеофилът в реакцията на добавяне?
О: Нуклеофилът е молекулата, която отдава електрони на другата молекула, за да се образува нова връзка.
В: Какво е електрофил в реакцията на добавяне?
О: Електрофил е молекулата, която приема електроните за образуване на нова връзка.
В: По какво се различава реакцията на добавяне от реакцията на елиминиране?
О: Реакцията на добавяне включва две молекули, които се съединяват, за да образуват по-голяма молекула, докато реакцията на елиминиране включва разпадане на по-голяма молекула на две по-малки.
В: Какъв е примерът за реакция на добавяне?
О: Добавянето на вода през двойна връзка и нуклеофилната атака на карбонил са често срещани примери за реакции на добавяне.
В: Могат ли реакциите на добавяне да се осъществяват без двойни или тройни връзки?
О: Не, реакциите на добавяне изискват двойни или тройни връзки в поне една от участващите молекули.
обискирам