Елиминационни реакции в органичната химия — механизъм и видове (E1, E2)
Елиминационни реакции в органичната химия: ясен преглед на механизми Е1 и Е2, стъпки, условия и примери при образуване на двойни връзки.
В органичната химия реакцията на елиминиране е реакция, при която някои атоми или група атоми се отнемат от по-голяма молекула. Обикновено чрез тази реакция се създава двойна или тройна връзка.
Съществуват два основни начина за провеждане на реакция на елиминиране. Първият се нарича Е1. Тя се извършва в две стъпки. Ако в молекулата има добра напускаща група, тя може да напусне сама. След това база или друго вещество може да отнеме другата група. Вторият начин се нарича Е2. Той се осъществява само на една стъпка. В този случай основата отнема едната група, като в същото време оставящата група си отива.
Често срещана реакция на елиминиране е при алкохолите. Ако наоколо има силна киселина, една молекула вода може да бъде елиминирана, за да се образува двойната връзка.
Механизъм и кинетика
- E1 (двуфазен механизъм): Напускащата група първо се отделя и образува карбокатион (стъпка с образуване на междинен продукт), след което база отнема протон и се формира алкен. Кинетиката е първичен ред спрямо субстрата: rate = k[субстрат]. Карбокатионът диктува стабилността и скоростта (третични > вторични > първични). Възможни са реарранжирания (пренареждане на атоми/групи), които да доведат до по-стабилен карбокатион и различен продукт.
- E2 (концертен механизъм): Елиминирането става в една стъпка — основата взема протон и в същия момент напускащата група излиза. Кинетиката е втори ред: rate = k[субстрат][база]. Механизмът изисква правилна пространствена подредба — често анти-перипланарна (анти) ориентация между H и напускащата група за оптимална орбитална наслагване.
- E1cb: Елиминиране чрез образуване на анионен междинен продукт (конюгиран база-образуван карбанционен аналог), често при субстрати със силно електроотрицателни заместители или когато напускащата група е лоша. Характерно за някои кондензации и реакции при α-водороди до електроноатегателни групи.
Фактори, които влияят на пътя на елиминация
- Субстрат: Третичните центрове по-скоро протичат чрез E1; първичните предпочитат E2 (ако има силна база).
- Качество на напускащата група: Добра напускаща група (напр. халогениди, вода след протониране) улеснява както E1, така и E2; лошите напускащи групи могат да изискват активиране или E1cb механизъм.
- Сила и стеричност на базата: Силните, малки бази (OH-, OR-) благоприятстват образуване на по-стабилен алкен (Zaitsev), докато големи стерично затруднени бази (например KOtBu) дават по-често Хофман продукт (по-малко замърсен/понякога по-малко заместен алкен).
- Разтворител: Полярните протични разтворители подкрепят карбокатионни междинни продукти → E1; аполярни или полярни апротични среда могат да повлияват скоростите и селективността при E2.
- Температура: По-висока температура обикновено благоприятства елиминацията спрямо заместването, тъй като елиминирането има по-голям положителен енталпиен/ентропийн принос при формиране на газообразни продукти и двойни връзки.
Стереохимия
При E2 стъпката е концертна и пространствената ориентация е важна: H и напускащата група трябва да бъдат анти-перипланарни за максимално наслагване на σ и σ* орбиталите. В циклични системи (напр. циклогексан) това често означава, че заместителите трябва да бъдат в транс-диаксиална позиция, за да може да се проведе елиминацията.
Селективност: Zaitsev vs Hofmann
- Правило на Zaitsev: При елиминиране обикновено се образува по-заместен и по-стабилен алкен (по-заместен = Zaitsev продукт), особено при малки силни бази.
- Правило на Hofmann: При използване на големи стерично затруднени бази често се получава по-малко заместен алкен (Hofmann продукт).
Примери
- Дехидратация на алкохолите в присъствието на силна киселина — често E1 механизъм за третични алкохоли, води до образуване на алкени (пример: tert-бутилов алкохол → изобутен след загряване с H2SO4).
- Дехалогениране (отстраняване на H-X) от алкилхалогениди с KOH/EtOH или с бази като KOtBu — типичен пример за E2.
- Елиминации, които преминават през E1cb междинен анион, често се срещат при β‑дикарбонилни съединения и при кондензации, когато α‑протоните са активирани от електроотрицателни групи.
Елиминация срещу нуклеофилна замяна
В практиката често има конкуренция между елиминация (E1/E2) и нуклеофилна замяна (SN1/SN2). Фактори, които изместват равновесието в полза на елиминацията, са: по-висока температура, силни бази, стерично затруднен субстрат (ограничава SN2), добри напускащи групи и полярни протични разтворители (за SN1/E1). Контролирайки тези условия (температура, вида на базата, разтворител), може да се постигне желаната реакция и продукт.
Практически съвети
- За получаване на по-заместен алкен използвайте малки силни бази и умерени температури.
- Ако искате Hofmann продукт — използвайте голяма стерично затруднена база и по-ниска полярност на средата.
- При реакции, при които карбокатионен междинен продукт е възможен, бъдете внимателни за реарранжирания и очаквайте смеси от продукти.
Тези принципи покриват основните типове и фактори на реакциите на елиминиране (E1, E2 и E1cb) в органичната химия и дават насоки за предвиждане и контролиране на продуктите при реални синтетични приложения.
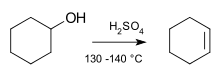
Реакция на елиминиране в молекулата на циклохексанола
Въпроси и отговори
В: Какво представлява реакцията на елиминиране в органичната химия?
О: Реакция на елиминиране е, когато някои атоми или група атоми се отнемат от по-голяма молекула, като обикновено се получава двойна или тройна връзка.
В: Кои са двата основни начина за извършване на реакция на елиминиране?
О: Двата основни начина за извършване на реакция на елиминиране са Е1 и Е2.
В: Каква е разликата между Е1 и Е2?
О: Е1 се извършва на два етапа, докато Е2 се извършва само на един етап. Е1 включва самостоятелно напускане на група, след което основа или друго вещество отнема другата група. При Е2 основата отнема едната група, като в същото време оставящата група си отива.
Въпрос: Кога протича една често срещана реакция на елиминиране?
О: Често срещана реакция на елиминиране се случва при алкохолите, когато наблизо има силна киселина и може да се елиминира молекула вода, за да се образува двойната връзка.
Въпрос: Какво представлява напускащата група в реакцията на елиминиране?
О: Оставящата група е молекула или атом, който може да напусне сам реакцията на елиминиране.
Въпрос: Какво представлява основата в реакцията на елиминиране?
О: Основата е вещество, което може да отнеме група в реакция на елиминиране.
Въпрос: Може ли реакцията на елиминиране да доведе до тройна връзка?
О: Да, елиминационната реакция може да доведе до тройна връзка.
обискирам