Тиоли — органични съединения със сулфхидрилна (R–SH) група
Всичко за тиолите (R–SH): свойства, реактивност, роля в биологията и ежедневието — миризма, окисление, киселинност и значението на цистеина.
Тиолът е молекула, която има група R-SH. Тиолите са като алкохолите, при които кислородният атом е заменен със серен. Те често имат много силна и неприятна миризма. Тиолите се добавят към природния газ, за да могат хората да усещат миризмата му. Това е така, защото метанът няма миризма, но може да се взриви много лесно.
Основни физико-химични свойства
В сравнение с алкохолите, тиолите имат по-слабо водородно свързване (S–H···O), затова техните точка на кипене и разтворимост във вода обикновено са по-ниски от тези на сходните по молекулно тегло алкохоли. Сярата е по-голям и по-поляризируем атом от кислорода, което прави тиолите по-лесно окисляващи се и по-реактивни в някои отношения.
Типичните алкилтиоли са с pKa ≈ 8–11 (алфа-алкилтиоли около 10), което ги прави значително по-киселинни от алкохолите (pKa ≈ 16–18). При отнемане на протон се образува тиолатният анион (RS–), който е добър нуклеофил и участва в множество органични реакции.
В IR спектъра S–H връзката дава слабо, но характерно поглъщане около 2550–2600 cm−1. Миризмата на някои тиоли (особено нискомолекулни) е много силна — примери са метантиол (метантиол, CH3SH) и други низши тиоли.
Номенклатура и примери
Старото обиходно наименование за тиоли е „меркаптани“. В IUPAC системата тиолите се означават чрез суфикса „-тиол“ (например етан-1-тиол). Както при алкохолите, термините „първичен“, „вторичен“ и „третичен“ могат да се използват за описание на типа въглерод, свързан със серния атом (алкил-тиоли).
Една от естествените аминокиселини, цистеинът, има тиол в структурата си. Два цистеинови остатъка в белтък могат да образуват дисулфидна връзка (цистин) чрез окисление – това е ключов механизъм за стабилизиране на третичната и четвъртичната структура на белтъците.
Основни реакции
- Окисление: два R–SH могат да се окислят до R–S–S–R (дисулфиди). Това е обратим процес чрез съответните редуциращи/окислителни агенти.
- Образуване на тиолати: при действието на основа (или изгубване на протон) тиолът образува RS–, силен нуклеофил, който участва в нуклеофилно заместване и други реакции.
- Алкилиране: тиолатите могат да бъдат алкилирани, давайки тиоетери (R–S–R').
- Тиол-ене и други радикални/каталитични реакции: тиолните групи участват в добавъчни и трансферационни реакции в органичния синтез.
Приготвяне
Често тиолите се получават чрез нуклеофилно заместване на халогеналкани с тиолатни соли (RX + RS– → R–S–R + X–) или чрез транстефикация и редукция на дисулфиди. В лабораторни и промишлени условия има множество методи в зависимост от желаната структура и чистота.
Биологично значение и приложения
Тиолните групи са много важни в биохимията. Освен че цистеинът участва в образуването на дисулфидни мостове в белтъци, малки молекули като глутатион съдържат тиолна група и служат като редуциращи агенти и детоксиканти в клетката.
В промишлеността и ежедневието тиолите имат приложения като междинни продукти в органичния синтез, като добавки за ароматизиране или дегазиране (прибавяне на характерна миризма към безароматни, но опасни газове). За присвояване на миризма в природния газ често се използват нискомолекулни меркаптани, напр. трет-бутилмеркаптан или етантиол (етан-2-тиол), понеже са миризливи дори в много ниски концентрации.
Безопасност и миризма
Много тиоли имат силна, неприятна миризма и са лесно разпознаваеми дори при много ниски концентрации. Освен неприятния мирис, някои тиоли могат да бъдат токсични, корозивни или лесно запалими. Работи се с подходяща вентилация, защитни ръкавици и очила, а по-опасните реакции се извършват под инертна атмосфера, когато е необходимо.
Също така, поради лесната окисляемост на тиолите, те могат да променят ароматните или химичните свойства на смеси при излагане на въздух — например образуването на дисулфиди често води до промяна на миризмата.
Сумиране
Тиолите (R–SH) са серосъдържащи аналози на алкохолите с отличителни химични и физични свойства: по-голяма киселинност, по-висока нуклеофилност в депротонирана форма, лесна окисляемост до дисулфиди и характерна силна миризма. Те са важни както в органичния синтез, така и в биологията и индустриалните приложения.
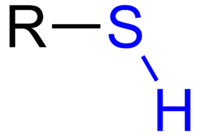
Обща формула за тиол
Въпроси и отговори
В: Какво представлява тиолът?
О: Тиолът е молекула, която има R-SH група.
В: По какво тиолите приличат на алкохолите?
О: Тиолите приличат на алкохолите с кислороден атом, заменен със серен.
В: Защо тиолите се добавят към природния газ?
О: Тиолите се добавят към природния газ, за да могат хората да усещат миризмата му, тъй като метанът, който е без мирис, може да експлодира много лесно.
В: Каква е силната и неприятна миризма, свързана с тиолите?
О: Тиолите често имат много силна и лоша миризма.
В: Какво се случва, когато база отнеме протон от тиол?
О: Когато основата отнеме протона, тиолът може да стане нуклеофил.
В: Какъв вид киселина са тиолите?
О: Тиолите са доста кисели, повече от алкохолите.
В: Има ли някоя от естествените аминокиселини тиол в структурата си?
О: Да, една от естествените аминокиселини, цистеинът, има тиол в структурата си.
обискирам