Сулфоксид: определение, структура, свойства и приложения (DMSO)
Научете всичко за сулфоксидите (DMSO): структура, хиралност, химични свойства, миризма и приложения като разтворител и лиганди в синтеза и биохимията.
Сулфоксидът е молекула, в която един серен атом е свързан с два въглерода и един кислороден атом. Получава се от окисляването на тиоетери, без да се стига до сулфона. Подобно на много молекули, съдържащи сяра, сулфоксидът понякога може да мирише много.
Сулфоксидите могат да се запишат с общата формула R-S(=O)-R'. Сярата има двойна връзка с кислорода и единични връзки с въглерода. Това оставя една самотна двойка на атома. Това означава, че формата на този атом е тетраедрична. Това означава също, че сярата може да бъде хирален център. Сулфоксидите се използват като добри лиганди за преходни метали.
Важна молекула от този вид е диметилсулфоксидът. Нарича се още DMSO. Използва се като разтворител при много реакции, особено в биохимията.
Определение и строеж — по-подробно
Сулфоксидът е клас съдържание на сяра с обща структурна формула R–S(=O)–R'. Ковалентната връзка между сяра и кислород има частичен двойновръзен характер (често се изобразява като S=O), а самата сяра притежава и несвързана електронна двойка. Геометрично около серния атом молекулата е приблизително тетраедрична, поради което заместителите R и R' могат да дават хиралност — съществуват оптически активни (енантиеомери) сулфоксиди, които при подходящи условия могат да бъдат изолирани.
Синтез и реактивност
- Най-разпространеният път за приготвяне на сулфоксиди е частичното окисление на тиоетери (R–S–R') до R–S(=O)–R'. За целта се използват меко окислителни агенти като водороден пероксид (H2O2), органични пероксиди или пероксикислоти (например m-CPBA), при контролиране на степента на окисляване, за да не се формира по-окисленият сулфон (R–SO2–R').
- Сулфоксидите са активно участващи в органична химия: участват в Pummerer-реакция, могат да бъдат преконвертирани до сулфони или до други функционални групи и често служат като междинни продукти при синтеза на по-сложни молекули. DMSO е ключов реагент в Swern-окислението (активиране на DMSO с оксалилхлорид или други агенти за окисляване на алкохоли до алдехиди/кетони).
- Хиралните сулфоксиди могат да се използват като хирални източници или лиганди в асиметрични реакции — тяхната хиралност е стабилна при много условия и може да контролира пространственото строене на продуктите.
Физични и химични свойства
- Полярност: сулфоксидите са полярни молекули. DMSO (диметилсулфоксид) е силно полярен, апротичен разтворител, напълно смесим с вода.
- Точки на топене и кипене (пример DMSO): топене около +18.5 °C и точка на кипене ~189 °C. Поради високата си точка на кипене DMSO е удобен за реакции при повишени температури.
- Спектрални характеристики: S=O връзката дава интензивен силен пик в IR спектъра, обикновено в областта около 1 030–1 070 cm−1 за много сулфоксиди.
- Лигандно поведение: сулфоксидите са добри неутрални лиганди за преходни метали; координират най-често чрез кислородния атом (O-координация), но в някои случаи могат да проявяват и S-координация. Те стабилизират различни валентни състояния на металите и намират приложение в катализа.
Примери и приложения — фокус върху DMSO
- Разтворител: DMSO е един от най-широко използваните полярни апротични разтворители в органичната синтеза и биохимия — разтваря както полярни, така и много неполярни вещества, често позволява реакции, които не протичат в по-малки раствоители.
- Биологични приложения: DMSO служи като криопротектант при замразяване на клетки и тъкани (често в 10% концентрация), тъй като намалява формирането на ледени кристали. Използва се и при някои медицински приложения (напр. локално приложение при ветеринарна медицина и в специфични клинични индикации).
- Реагент в органичната химия: DMSO участва в ред реакции като Swern-окисление и като източник на активирани сулфониеви видове. Използва се и за извършване на специфични трансформации и механистични междинни етапи.
- Катализа и комплексообразуване: сулфоксиди като лиганди подобряват каталитичните свойства на някои метални комплекси и влияят на селективността и реактивността при каталитични реакции.
Безопасност и практически бележки
- DMSO лесно прониква през кожата и може да пренася разтворени в него вещества директно в кръвотока. Затова при работа с DMSO и други сулфоксиди е важно да се носи подходяща защитна екипировка (ръкавици, очила) и да се избягва контакт с кожата.
- Поради своята способност да разтваря и пренася други съединения, трябва да се внимава за чистотата на разтворителя — токсични или дразнещи примеси могат да преминат през кожата заедно с DMSO.
- Много сулфоксиди и особено техните реакционни смеси могат да имат силна миризма (неприятна, „чеснова“ или характерна сярана миризма). Работете в добре проветрени помещения или в аспирация.
В обобщение, сулфоксидите са важен и многолик клас съединения: от основни структурни функции (хирални центрове, полярни функционални групи) до практическо приложение като разтворители, реагенти и лиганди. DMSO е най-добре познатият представител и онзи, който показва най-ясно комбинацията от физични свойства и полезност в лабораторната и приложна практика.
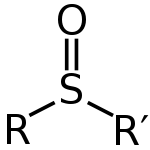
Обща структура на сулфоксид
Въпроси и отговори
В: Какво е сулфоксид?
О: Сулфоксидът е молекула, която има серен атом, свързан с два въглерода и един кислороден атом.
В: Откъде идва сулфоксидът?
О: Сулфоксидът се получава при окисляване на тиоетери, без да се стига до сулфон.
В: Каква е общата формула на сулфоксидите?
О: Общата формула на сулфоксидите е R-S(=O)-R'.
В: Каква е формата на атома в сулфоксидите?
О: Формата на атома в сулфоксидите е тетраедрична.
В: Може ли сярата да бъде хирален център в сулфоксидите?
О: Да, сярата в сулфоксидите може да бъде хирален център.
В: Какво представлява диметилсулфоксидът и каква е неговата употреба?
О: Диметилсулфоксидът, известен също като DMSO, е важна молекула на сулфоксида и се използва като разтворител за много реакции, особено в биохимията.
В: Защо сулфоксидите се използват като добри лиганди за преходни метали?
О: Сулфоксидите се използват като добри лиганди за преходни метали поради способността им да се координират с метални йони благодарение на електронната двойка на серния атом.
обискирам