SN2 (бимолекулярно нуклеофилно заместване) — дефиниция и механизъм
SN2 (бимолекулярно нуклеофилно заместване) — ясна дефиниция и визуален механизъм: стъпки, кинетика, примери и фактори, влияещи на реакцията.
Реакцията SN 2 (известна също като двумолекулно нуклеофилно заместване) е реакция на заместване в органичната химия. Тя е вид нуклеофилно заместване, при което самотна двойка от нуклеофил атакува електронодефицитен електрофилен център и се свързва с него. По този начин се изхвърля друга група, наречена "напускаща група". Така входящата група замества напускащата група в една стъпка. Тъй като в бавната, определяща скоростта стъпка на реакцията участват два реагиращи вида, това води до наименованието бимолекулярно нуклеофилно заместване или SN 2. Сред неорганичните химици реакцията SN 2 често е известна като механизъм на взаимозамяна.
Основни характеристики и кинетика
Концертен механизъм: SN2 е концертна (едностъпкова) реакция — образуването на връзка между нуклеофила и въглеродния център и разкъсването на връзката с напускащата група стават едновременно, през преходно състояние.
Законово уравнение за скоростта: скоростта на реакцията следва вторичен порядък и зависи едновременно от концентрациите на субстрата (R–LG) и нуклеофила (Nu): rate = k [R–LG][Nu].
Структура на преходното състояние и стереохимия
При SN2 нуклеофилът атакува въглеродния атом от страната, противоположна на напускащата група (т.нар. задно или „backside“ нападение). Преходното състояние е петикоординатно, със частично образувана нова връзка и частично нарушена стара връзка — често се описва като тригонална бипирамидална геометрия с удължени връзки.
Инверсия на Валенда (Walden inversion): резултатът от задното нападение е инвертирана абсолютна конфигурация на централния въглерод (R ↔ S). Това е характерна стереохимична следа за механизма SN2.
Фактори, които ускоряват или забавят SN2
- Субстрат (стеричност): реактивността следва общо порядък: метил > първичен > вторичен >> третичен (третични алкилхалиди почти не протичат по SN2 поради стерично отблъскване).
- Нуклеофил: по-силните нуклеофили (обикновено по-заредени и по-малко електроотрицателни) ускоряват SN2. Примери: OH–, CN–, RS–. Поляризуемостта също повлиява — големи, поляризуеми йони са добри нуклеофили в полярни протични среди.
- Напускаща група: по-добри напускащи групи ускоряват реакцията (I– > Br– > Cl– >> F–). Стабилността на оставения анион е важна.
- Разтворител: полярни апроти́чни разтворители (напр. DMSO, DMF, ацетон) благоприятстват SN2, тъй като не солватират силно нуклеофилите и те остават „активни“. Полярните протични (напр. H2O, спиртове) солватират и отслабват нуклеофила, което забавя реакцията.
- Електронни ефекти и съседни групи: бензилови и аллилни центрове често ускоряват SN2 поради делокализация на заряда в преходното състояние. Също така участие на съседни групи (neighboring group participation) може да промени механизма.
Конкуриращи процеси
При вторични и особено при третични субстрати често се получава конкуренция между SN2 и елиминиране E2. Силни, големи бази (напр. t-BuO–) предпочитат E2; по-малки, силни нуклеофили (напр. OH–, alkoxidi) могат да дават смес от продукти в зависимост от условията (температура, разтворител).
Примери и практическо приложение
- Класически пример: CH3Br + OH– → CH3OH + Br– — бърза SN2 реакция с инверсия (за метилови съединения няма стереохимичен въпрос).
- Заместителни реакции при синтез: SN2 се използва за въвеждане на нуклеофилни групи (алкохолати → етери, цианиди → нитрилни групи и т.н.).
- Арили и винилни халогениди обикновено не реагират по SN2, защото целевият въглерод е sp2-гибридизиран и достъпът за задно нападение е блокиран.
Енергетична диаграма (интуитивно)
В типичната енергетична профилна крива SN2 има една енергийна бариера (преходно състояние) между реагентите и продуктите. Енергията на активация зависи от описаните фактори (стеричност, нуклеофил, напускаща група, разтворител).
Кратки практически съвети за лабораторен синтез
- За да насърчите SN2: използвайте метилови или първични халогениди, силен нуклеофил и полярен апротичен разтворител.
- Ако наблюдавате голямо количество елиминация (E2), опитайте да намалите температурата, да смените разтворителя или да използвате по-слаб, но по-специфичен нуклеофил.
Обобщено: SN2 е бърз, едностъпков механизъм на нуклеофилно заместване с характерна инверсия на конфигурацията и ясно зависим от стеричните и електронните свойства на реагентите и разтворителя. Познаването на тези фактори позволява да се планират и оптимизират реакции в органичния синтез.
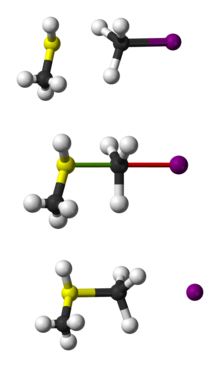
Представяне с топка и пръчка на реакцията SN 2 на CH3 SH с CH3 I
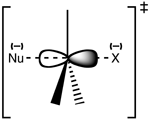
Структура на преходното състояние SN 2
Механизъм на реакцията
Реакцията най-често протича в алифатен sp3 въглероден център с прикрепена към него електроотрицателна, стабилна оставяща група - "X" - често халогенен атом. Разкъсването на връзката C-X и образуването на новата връзка C-Nu се случват едновременно, за да се образува преходно състояние, в което въглеродът, подложен на нуклеофилна атака, е пентакоординатен и приблизително sp2 хибридизиран. Нуклеофилът атакува въглерода на 180° спрямо напускащата група, тъй като това осигурява най-добро припокриване между самотната двойка на нуклеофила и антисвързващата орбитала C-X σ*. След това оставящата група се изтласква от противоположната страна и се образува продуктът.
Ако субстратът, който е подложен на нуклеофилна атака, е хирален, това може да доведе, макар и не задължително, до инверсия на стереохимията, наречена инверсия на Walden.
В един пример за реакция SN 2 атаката на OH −(нуклеофил) върху бромоетан (електрофил) води до получаване на етанол, като бромидът се изхвърля като напускаща група:
Реакция SN 2 възниква, ако обратният път на атака не е блокиран от други атоми в молекулата (стерилно възпрепятствани от заместители на субстрата). Така че този механизъм обикновено се проявява при необезпокояван първичен въглероден център. Ако в близост до напускащата група има стерилна преграда върху субстрата, като например при третичен въглероден център, заместването ще използва механизма SN 1, а не SN 2 (SN 1 би бил по-вероятен и при блокирани молекули, тъй като може да се образува достатъчно стабилен карбокатионов междинен продукт).
В координационната химия асоциативното заместване протича по механизъм, подобен на този на SN 2.
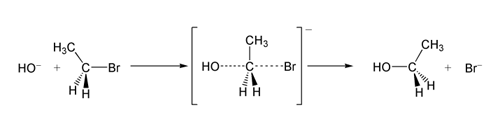
SN 2 реакция на бромоетан с хидроксиден йон.
Фактори, влияещи върху скоростта на реакцията
Четири фактора влияят върху скоростта на реакцията:
- Субстрат. Субстратът играе най-важната роля в определянето на скоростта на реакцията. Това е така, тъй като нуклеофилът атакува от задната страна на субстрата, като по този начин разкъсва връзката между въглеродната група и образува връзката въглерод-нуклеофил. Следователно, за да се увеличи максимално скоростта на реакцията SN 2, гърбът на субстрата трябва да бъде възможно най-безпрепятствен. Като цяло това означава, че най-бързо реагират метиловите и първичните субстрати, следвани от вторичните субстрати. Третичните субстрати не участват в реакциите SN 2 поради стерични пречки.
- Нуклеофил. Подобно на субстрата, стеричното препятствие влияе върху силата на нуклеофила. Метоксидният анион например е едновременно силна основа и нуклеофил, защото е метилов нуклеофил и по този начин е много безпрепятствен. Терт-бутоксидът, от друга страна, е силна основа, но слаб нуклеофил, тъй като трите му метилови групи възпрепятстват приближаването му към въглерода. Силата на нуклеофила се влияе и от заряда и електроотрицателността: нуклеофилността нараства с увеличаване на отрицателния заряд и намаляване на електроотрицателността. Например OH- е по-добър нуклеофил от водата, а I- е по-добър нуклеофил от Br- (в полярни протични разтворители). В полярни апротични разтворители нуклеофилността се увеличава нагоре по колоната на периодичната таблица, тъй като няма водородна връзка между разтворителя и нуклеофила. В този случай нуклеофилността е огледална на основността. Следователно I- би бил по-слаб нуклеофил от Br- , защото е по-слаба основа.
- Разтворител. Разтворителят влияе върху скоростта на реакцията, тъй като разтворителите могат да заобикалят или да не заобикалят нуклеофила, като по този начин възпрепятстват или не възпрепятстват приближаването му към въглеродния атом. Полярните апротични разтворители, като тетрахидрофуран, са по-добри разтворители за тази реакция, отколкото полярните протични разтворители, защото полярните протични разтворители ще бъдат разтворени от водородната връзка на разтворителя с нуклеофила. Това му пречи да атакува въглерода с напускащата група.
- Напускане на групата. Оставящата група влияе върху скоростта на реакцията. Колкото по-стабилна е оставящата група, толкова по-вероятно е тя да вземе двата електрона от връзката на оставящата група с въглерода, когато нуклеофилът атакува въглерода. Следователно колкото по-слаба е оставящата група като конюгирана основа, толкова по-добра е оставящата група. Аналогично, колкото по-силна е съответната ѝ киселина, толкова по-добра е оставящата група. Примери за добри оставящи групи са халогенидите (с изключение на флуорида) и тозилатите. Но HO- и H2 N- не са добри оставящи групи.
Кинетика на реакцията
Скоростта на реакцията SN 2 е от втори порядък, тъй като определящата скоростта стъпка зависи от концентрацията на нуклеофила [Nu− ], както и от концентрацията на субстрата [RX].
r = k[RX][Nu− ]
Това е основната разлика между механизмите SN 1 и SN 2. При реакцията SN 1 нуклеофилът атакува след приключване на ограничаващата скоростта стъпка. Но при SN 2 реакцията нуклеофилът изтласква напускащата група в ограничаващата стъпка. С други думи, скоростта на реакциите SN 1 зависи само от концентрацията на субстрата, докато скоростта на реакциите SN 2 зависи от концентрацията както на субстрата, така и на нуклеофила. В случаите, когато са възможни и двата механизма (например при вторичен въглероден център), механизмът зависи от разтворителя, температурата, концентрацията на нуклеофила или от напускащата група.
Реакциите SN 2 обикновено се предпочитат в първични алкилхалогениди или вторични алкилхалогениди с апротичен разтворител. Те протичат с незначителна скорост в третични алкилхалогениди поради стерични пречки.
SN 2 и SN 1 са двете крайности на една подвижна скала на реакциите. Възможно е да се открият много реакции, които проявяват в механизмите си характер както на SN 2, така и на SN 1. Например, възможно е да се получи контактна йонна двойка, образувана от алкилхалогенид, при която йоните не са напълно разделени. Когато те се подложат на заместване, стереохимията ще бъде обърната (както при SN 2) за много от реагиращите молекули, но при няколко от тях може да се наблюдава запазване на конфигурацията. Реакциите SN 2 са по-често срещани от реакциите SN 1.
Състезание E2
Често срещана странична реакция, протичаща при реакциите SN 2, е елиминирането на E2: входящият анион може да действа като основа, а не като нуклеофил, като отстранява протон и води до образуване на алкен. Този ефект може да се демонстрира в реакцията в газова фаза между сулфонат и прост алкилбромид, протичаща в масспектрометър:

При етилбромид реакционният продукт е предимно продукт на заместване. С увеличаване на стеричните препятствия около електрофилния център, както е при изобутилбромида, заместването не е благоприятно и преобладаващата реакция е елиминиране. Други фактори, благоприятстващи елиминирането, са силата на основата. С по-слабо базичния субстрат бензоат изопропилбромид реагира с 55 % заместване. Като цяло реакциите в газова фаза и реакциите в разтворна фаза от този тип следват едни и същи тенденции, въпреки че при първата отпадат ефектите на разтворителя.
Механизъм за кръгово движение
Разработката, която привлича вниманието през 2008 г., се отнася до SN 2 кръгов механизъм, наблюдаван при реакция в газова фаза между хлоридни йони и метил йодид със специална техника, наречена кръстосан молекулярен лъч. Когато хлоридните йони имат достатъчна скорост, енергията на получените йодидни йони след сблъсъка е много по-ниска от очакваната и се предполага, че енергията се губи в резултат на пълното завъртане на метиловата група около йодния атом, преди да се осъществи действителното изместване.
Свързани страници
- Реакция на заместване
- SN 1 реакция
Въпроси и отговори
В: Какво представлява реакцията SN2?
О: Реакцията SN2 е реакция на заместване в органичната химия, при която нуклеофил атакува електрофилен център с недостиг на електрони, изхвърляйки напускаща група, и след това я замества в една стъпка.
Въпрос: Какъв вид реакция на заместване е реакцията SN2?
О: Реакцията SN2 е вид реакция на нуклеофилно заместване.
В: Колко вида реагиращи вещества участват в бавната, определяща скоростта стъпка на реакцията SN2?
О: В бавната, определяща скоростта стъпка на реакцията SN2 участват два вида реактиращи вещества.
В: Какво е значението на наименованието "бимолекулярно нуклеофилно заместване" за реакцията SN2?
О: Названието "двумолекулно нуклеофилно заместване" за реакцията SN2 се отнася до факта, че два реагиращи вида участват в бавната, определяща скоростта стъпка на реакцията.
В: Какво е нуклеофил в контекста на реакцията SN2?
О: Нуклеофил е молекула или йон, който предоставя самотна двойка електрони, за да образува химична връзка.
В: Какво е електрофил в контекста на реакцията SN2?
О: Електрофил е молекула или йон, който приема двойка електрони, за да образува химична връзка.
В: Как е известна реакцията SN2 сред неорганичните химици?
О: Сред неорганичните химици реакцията SN2 често е известна като механизъм на обмен.
обискирам