Механизъм на химичната реакция — определение, стъпки и видове
Научете механизма на химичната реакция: стъпки, междинни продукти, преходни състояния и ключови видове (нуклеофилно заместване, елиминиране, добавяне).
Механизмът на реакцията представлява описание стъпка по стъпка на протичането на дадена химична реакция. Обикновено при дадена реакция може да се види само общата промяна — реагенти преобразувани в продукти. Междинните продукти реагират твърде бързо, за да бъдат видени при стандартни условия; те се наричат междинни продукти и при преминаването от един междинен продукт към друг се преминава през преходно състояние. Въпреки това е важно да се разберат всички стъпки, които правят общата промяна. Това е така, защото тогава човек може да:
- предскаже и контролира скоростта на реакцията;
- променя условията, за да увеличи добива или селективността;
- разработи катализатори или защитни групи;
- разбере стереохимичните резултати (например инверсия или рацемизация).
Елементи и стъпки в механизма
Всяка реакция се състои от няколко по-прости, т.нар. елементарни стъпки. Всяка елементарна стъпка описва едно единично събитие — например пресичане на връзка, формиране на връзка или прехвърляне на протон. Някои важни понятия:
- Елементарна стъпка — може да бъде едномолекулна (унимолекулна), двумолекулна (бимолекулна) и т.н.; от това зависи моларността и формата на скоростното уравнение на тази стъпка.
- Междинен продукт — видим или изолиран вид, който съществува за кратко между елементарните стъпки. Някои междинни продукти могат да бъдат уловени или характеризирани, други са прекалено реактивни.
- Преходно състояние — енергетичен максимум по пътя на реакцията; не е изолиран, но неговите свойства влияят на енергията на активация.
- Рейт-определяща (ограничителна) стъпка — най-бавната елементарна стъпка, която контролира цялата скорост на процеса.
Енергийна диаграма и реакционна координата
Механизмът често се илюстрира чрез енергийна диаграма срещу реакционна координата. На диаграмата се виждат последователни върхове (преходни състояния) и долини (междинни продукти). Основни наблюдения:
- Височината на върха определя енергията на активация за тази стъпка.
- Когато има няколко върха, най-високият обикновено съответства на рейт-определящата стъпка.
- Катализаторите понижават енергията на активация, като често променят механизма (представят алтернативен път с по-ниски върхове).
Видове механизми в органичната химия
Съществуват много видове механизми, но в органичната химия най-често срещаните и важни са:
- Нуклеофилно заместване — например SN1 и SN2 (в статията е даден общият термин нуклеофилно заместване). При SN2 процесът е концертен (едностъпков): нуклеофил атакува субстрата и групата напуска едновременно; резултатът често е стереохимична инверсия (backside attack). При SN1 образуването на карбокатион (междинен продукт) прави процеса двустъпков и може да доведе до частична или пълна рацемизация.
- Елиминaция — примери: E2 и E1. E2 е бимолекулна, концертна стъпка (често изисква анти-паралелно разположение на атомите, които напускат), докато E1 е двустъпков процес чрез карбокатион.
- Дoбавяне — например електрофилно добавяне към двойни връзки (алкени) или радикално добавяне. Механизмите определят регио- и стереоселективността на добавянето.
- Радикални вериги — включват инициация, пропагация и терминация (напр. хлориране на алкани). Радикалните механизми използват едноелектронни процеси и са характерни за високорeактивни междинни радикали.
- Перицкилични реакции — конциертни процеси (като Diels–Alder), при които множество връзки се променят едновременно чрез цикличен преходен щит.
- Окислително-възстановителни (редокс) механизми — включват прехвърляне на електрони; важни в органична и неорганична химия, както и в биохимични процеси.
Стрелкова нотация и електронно движение
Химиците често използват „бутане на стрелки“ (curved-arrow notation), за да покажат как електроните се движат по време на реакция. Някои правила:
- Двойна стрелка (с две пера) показва движение на електронна двойка (две частици).
- Едно перо (само една стрелка) показва движение на един електрон — използва се при радикални механизми.
- Стрелката винаги тръгва от източник на електрони (електронна двойка или радикал) и завършва към електрофилен център или връзка, която ще се счупи/образува.
Фактори, които влияят на механизма
Механизмът и скоростта на реакцията могат да бъдат повлияни от:
- Природата на реагентите — стабилност на междинните продукти (напр. стабилност на карбокати), силата на nucleofila или добър напускащ група.
- Солвент — полярните протонни/апротонни среди могат да стабилизират/дестабилизират йони и да променят механизма (напр. SN1 предпочитан във полярни протонни среди).
- Температура — по-висока температура обикновено ускорява процесите с по-голяма енергия на активация и може да промени баланса между конкуриращи механизми.
- Катализатори — киселини, основи, метали и ензими могат да отворят по-лесен път и да променят рейт-определящата стъпка.
Как се изучава механизъмът
За да се установи механизма, химиците използват различни експериментални и теоретични подходи:
- Кинетични изследвания — определяне на порядъка на реакцията и зависимостта на скоростта от концентрациите помагат да се идентифицира рейт-определящата стъпка.
- Изотопно маркиране — използване на стабилни или радиоактивни изотопи (например D, 13C) за проследяване кой атом къде отива.
- Спектроскопични методи — NMR, IR, UV-Vis и мас-спектрометрия за улавяне или наблюдение на междинни продукти.
- Улавяне на междинни продукти — химична „ловушка“, която реагира бързо с междинен продукт и позволява неговата идентификация.
- Квантово-химични изчисления — моделиране на енергийните повърхности и преходните състояния с цел подкрепа или предсказване на механизма.
Практически последици
Разбирането на механизма има практическо значение: избор на условия, катализатори и реактиви може да насочи процеса към желания продукт, да повиши добива или да намали нежелани странични продукти. При синтезите това позволява оптимизиране на стъпките, подбор на защитни групи и постигане на висока селективност и енергийна ефективност.
В заключение, изучаването на механизма на реакцията не е само академично упражнение — то е ключово за рационалния контрол и развитие на химични процеси както в изследователската, така и в промишлената и биохимичната практика.
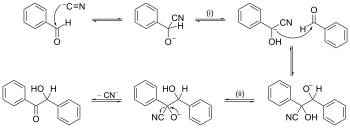
Пример за механизъм на реакция с избутване на стрелка
Въпроси и отговори
В: Какво представлява механизмът на реакцията?
Отговор: Реакционният механизъм е поетапно обяснение на начина, по който протича дадена химична реакция.
В: Защо е важно да се разберат всички стъпки в механизма на реакцията?
О: Важно е да се разберат всички стъпки в механизма на реакцията, за да се разберат трудните реакции или да се опитаме да накараме дадена реакция да протича по определен начин.
Въпрос: Какво представляват междинните продукти в една химична реакция?
О: Междинните продукти са нещата, които се получават между реакциите, които протичат твърде бързо, за да бъдат забелязани в химичната реакция.
В: Какво е преходно състояние в химична реакция?
О: Преходното състояние се пресича при преминаването от един междинен продукт в друг по време на химична реакция.
В: Кои са най-често срещаните видове механизми на реакции в органичната химия?
О: Най-често срещаните видове механизми на реакции в органичната химия са нуклеофилно заместване, елиминиране и добавяне.
Въпрос: Какво представлява бутането на стрелката в механизма на химичната реакция?
О: Понякога се използва за изобразяване на движението на електроните по време на реакция. Така лесно се вижда кои връзки се образуват и кои се разрушават по време на процеса.
В: Каква информация може да се получи от разбирането на механизма на реакцията?
О: Разбирането на механизма на реакцията може да даде информация за това как да накарате дадена реакция да протече по желания от вас начин или да разберете по-трудни реакции.
обискирам