Преходно състояние в химията — енергия на активация и механизъм
Разберете преходното състояние, енергията на активация и механизма на реакции — ключови понятия в химичната кинетика, методи за изследване и компютърни изчисления.
В една химична реакция преходното състояние е точката по пътя от реагентите към продуктите, при която свободната енергия е максимална. Тази енергия се нарича енергия на активиране (обозначавана често като Ea или като ΔG‡ при термодинамичен подход). На графика на енергия спрямо реакционна координата преходното състояние обикновено се маркира със символа на двойния кинжал ‡. Когато две или повече молекули се сблъскат с достатъчна енергия, за да достигнат и да преминат през преходното състояние, старите връзки могат да се разкъсат, а нови да се формират и реакцията да протече
Какво се случва в преходното състояние
Преходното състояние не е изолиран, стабилен вид, а моментично геометрично и електронно разпределение на атомите — „връх“ на енергийния пейзаж (saddle point). В него едновременно се изменят разстоянията и ъглите на връзките: някои връзки се разтягат и се скъсват, други се образуват. Продължителността на подобно състояние е изключително кратка — типично във времевия диапазон на фемтосекундите (10−15 s).
Разлика между преходно състояние и междинен продукт
Важно е да не се бъркат преходните състояния с междинните продукти. Междинните продукти се намират в енергийни минимуми по пътя на реакцията и могат да съществуват за значително по-дълго време (позволяват наблюдение и понякога изолиране). Преходните състояния са енергийни максимуми и не могат да бъдат изолирани; те представляват „преминаване“ между две минимуми (реагенти → междинен продукт → продукти или директно реагенти → продукти).
Ролята на енергията на активиране и кинетиката
Енергията на активиране определя скоростта на реакцията: колкото по-висока е тя, толкова по-малко частици имат необходимата енергия при дадена температура да преминат през преходното състояние и толкова по-бавно протича реакцията. Това е описано в класическата Арениусова връзка k = A e^(−Ea/RT). По-детайлният термодинамичен/статистически подход (теорията на активираните комплексни състояния, Eyring) свързва скоростната константа с свободната енергия на активация ΔG‡ чрез изрази, които включват ΔH‡ (енталпийна бариера) и ΔS‡ (ентропийен фактор).
Как се изследва преходното състояние
Преходните състояния са трудни за директно изучаване, защото са преходни и с много висока енергия. Въпреки това има няколко подхода за тяхното характеризиране:
- Компютърни методи: квантово-химични изчисления намират седлови точки на потенциалната повърхнина, характеризират ги с една въображаема честота и следват т.нар. intrinsic reaction coordinate (IRC), за да свържат преходното състояние с реагенти и продукти.
- Ултрамодерна спектроскопия: ултра бързи лазерни техники (фемтосекундна спектроскопия) позволяват проследяване на процесите, които протичат в мили- до фемтосекундния временен мащаб.
- Кинетични ефекти: измерване на скоростни константи, температурна зависимост (за определяне на Ea) и кинетични изотопни ефекти (KIE) дават информация за характера на прекъснатите/образуваните връзки в преходното състояние.
- Преходни аналогии: стабилни молекули, които имитират геометрията и електронното разпределение на преходното състояние (преходно-състояни аналози), често се използват за изучаване на ензимите и за дизайн на инхибитори.
Значение за механизма и катализа
Изучаването на преходните състояния е ключово за разбирането на механизмите на реакциите. Знанието за това кои връзки се създават и кои се разрушават в преходното състояние позволява да се различат консервативни (концертни) механизми от стъпкови (чрез междинни продукти) и помага при проектиране на реакционни условия и катализатори. Катализаторите работят, като понижават енергията на активация, често чрез стабилизиране на преходното състояние — това увеличава фракцията от сблъсъци, които водят до продукция, и ускорява реакцията без да променя равновесието.
Практически примери
- В SN2 реакции преходното състояние е „пентавалентно“ около въглерода и представлява концентрирано състояние, в което старата и новата връзка са частично оформени — това е класически пример на концертно преходно състояние.
- В SN1 механизма първият преход е свързан със създаването на карбокатион (междинен продукт), т.е. има отделно междинно състояние между преходните бариери.
- При перицитични реакции (например Diels–Alder) преходното състояние е симетрично и концертно, често с особености, описвани от постулата на Hammond (близост между преходното състояние и най-близкия крайнен вид по енергия).
Изследването на преходните състояния е част от химичната кинетика и механистичната химия и комбинира експериментални и теоретични методи, за да разкрие как и защо протичат химичните преобразувания. Разбирането им позволява по-добър контрол върху реакциите и по-ефективно проектиране на катализатори, лекарства и синтетични маршрути.
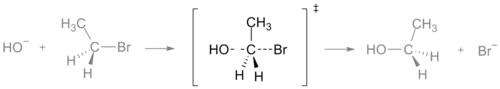
Преходно състояние на реакция SN2
Въпроси и отговори
Въпрос: Какво е преходното състояние в една химична реакция?
О: Преходното състояние е точката, в която има максимална стойност на енергията при химична реакция.
В: Какво представлява енергията на активация при химична реакция?
О: Енергията, която е необходима за протичането на дадена реакция, се нарича енергия на активиране.
В: Какво се случва, когато две или повече молекули се смесят в химична реакция?
О: Когато две или повече молекули се смесят, те се удрят една в друга. Ако се ударят с достатъчно енергия, за да преминат през преходно състояние, те ще реагират и ще образуват нови молекули.
Въпрос: За какво се използва символът за двоен кинжал (‡) в графика или чертеж на химична реакция?
О: Символът "двоен кинжал" (‡) се използва за обозначаване на преходното състояние в графика или чертеж на химична реакция.
В: Защо е трудно да се изследва преходното състояние при химична реакция?
О: Много е трудно да се изследва преходното състояние при химична реакция, защото то е с толкова висока енергия, че молекулите остават в тази форма за много кратко време, обикновено за фемтосекунди.
В: Какво представлява междинният продукт в химичната реакция?
О: Междинен продукт е молекула, която се намира в минимални енергийни точки в химичната реакция и може да живее много дълго време.
В: Защо изучаването на преходните състояния е важно за разбирането на механизмите на реакциите?
О: Изучаването на преходните състояния е важно за разбирането на механизмите на реакциите, защото помага да се определи как протича дадена реакция и как да се контролира или манипулира.
обискирам