Карбокатион (карбокация): дефиниция, хибридизация и реактивност
Карбокация: дефиниция, sp2 vs sp3 хибридизация, стабилност и реактивност — ясно и точно обяснение за студенти и практикуващи химици.
Карбокацията е йон с положително зареден въглероден атом. Зареденият въглероден атом в карбокацията е "секстет" (т.е. има само шест електрона във външната си валентна обвивка вместо осем валентни електрона). Въглеродните атоми с осем валентни електрона имат максимална стабилност (правило на октета). Поради това карбокациите често са реактивни, като се стремят да запълнят октета от валентни електрони, както и да си възвърнат неутралния заряд. Логиката би казала, че карбокациите имат sp3 хибридизация с празна sp3 орбитала, която дава положителен заряд. Въпреки това реактивността на карбокацията прилича повече на sp2 хибридизация с тригонална равнинна молекулна геометрия.
Електронна структура и хибридизация
Моделът, който днес обяснява най-добре структурата на много карбокации, е такъв с sp2 хибридизация на заредения въглерод. В този случай трите sp2 хибридни орбитали образуват σ‑връзки (или остават необвързани заместители), докато неизползваната p‑орбитала остава празна и е перпендикулярна на равнината. Това дава характерна тригонална равнинна геометрия около карбокацията с приблизително 120° ъгли. Празната p‑орбитала е мястото, където се локализира положителният заряд като дефицит на електронна плътност.
Фактори, които влияят на стабилността
- Алкилиращи заместители (индуктивен и хиперконюгационен ефект) — алкилни групи са донори на електронна плътност чрез индукция и най‑вече чрез хиперконюгация (делокализация на σ‑електрони от C–H или C–C връзки в празната p‑орбитала). Това прави реда на стабилност: третични > вторични > първични > метил, при липса на допълнителна делокализация.
- Резонансна делокализация — ако празната p‑орбитала се припокрива с π‑система (напр. в бензилов или аллилoв катион), положителният заряд се делокализира върху няколко атома, което значително увеличава стабилността. Примери: бензилов и аллилoв катион, тровилиев (tropylium) катион.
- Електронно‑атрактивни или донорни заместители — заместители с −I или −M ефект намаляват стабилността, докато донори (напр. O, N с донорен резонанс) могат да стабилизират чрез делокализация, когато имат възможност да подадат електронна плътност в системата.
- Структурни ефекти и не‑класически катиони — някои карбокации (напр. не‑класически norbornyl катион) показват делокализация чрез 2‑e/3‑c (две електрона, три центъра) връзки или мостови структури, което също променя стабилността и реактивността.
Класификация и примери
- Алкилови карбокации — метил, пърични, вторични, третични (нормален ред на стабилност поради алкилна хиперконюгация).
- Резонансно стабилизирани — бензилов, аллилoв, тропилиев и други, при които зарядът се делокализира върху π‑система.
- Окисоневрейни и хетероатомно стабилизирани — карбокации, които са съседни на O или N, често се стабилизират чрез донорен резонанс (например оксониеви катиони при протониране на алкохоли/етерни системи).
- Не‑класически катиони — случаи като 2‑ноρборнил катион, при които зарядът е делокализиран чрез мостова структура и не може да се опише с една стандартна резонансна формула.
Реактивност и типични процеси
Карбокациите са ключови междинни във множество органични реакции, защото са силни електрофили и лесно реагират със нуклеофили или губят протони:
- SN1 реакции — образуването на карбокация е често скоропределящата стъпка.
- E1 елиминации — карбокацията може да загуби протон, за да образува двойна връзка.
- Хидратиране/хидроксилиране на алкени — прекатиони при присъединяване на H+/H2O.
- Friedel–Crafts алкилиране/ациляване — образуване на карбокационни видове, които атакуват ароматни системи.
- Реаренжименти — карбокациите често претърпяват хидридни или алкилови прехвърляния (hydride/alkyl shifts), за да формират по‑стабилен катион.
Експериментални доводи и наблюдения
- NMR спектроскопия — дава информация за електронната среда и за наличието на равнинна структура (напр. характерни химични сдвъравания за сп2‑въглероди и наблюдение на делокализация).
- Кинетика — скоростни закони за SN1 и E1 реакции подпомагат наличието и стабилността на карбокации като междинни продукти.
- Изолация на стабилизирани катиони — някои силно делокализирани или пакетирани катиони (напр. тровилиев кат., стабилизирани от слабо нуклеофилни аниони) могат да бъдат наблюдавани или изолирани и характеризирани чрез рентгенова кристалография.
Практически бележки и заключение
Карбокациите са краткотрайни и често високо реактивни междинни, чието поведение определя редица органични трансформации. За правилното предсказване на реактивността трябва да се преценят два основни аспекта: дали положителният заряд може да бъде делокализиран (резонанс, не‑класически ефекти) и колко алкилни/донорни заместители могат да осигурят хиперконюгационно или индукционно стабилизиране. В практическа синтеза това определя избор на условия (киселина, разтворител, нуклеофил) и очаквани продуктови разпределения (реаренжименти, елиминации и т.н.).
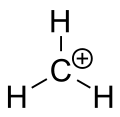
Карбениев йон на метана

терц-бутилов катион, демонстриращ планарна геометрия
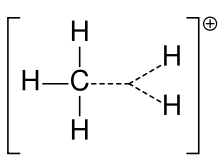
Карбониев йон на метана
Определения
Преди карбокацията често е наричана карбониев йон, но химиците се съмняват в точното значение. В съвременната химия карбокация е всеки положително зареден въглероден атом. Предложени са два специални вида: карбениевите йони са тривалентни, а карбониевите йони са пентавалентни или шествалентни. В учебниците на университетско ниво карбокациите се обсъждат само като карбениеви йони или се обсъждат карбокации с бегло споменаване на по-старата фраза карбениев йон или карбениеви и карбениеви йони. Един учебник и до днес остава с по-старото наименование карбениев йон за карбениев йон и запазва израза хипервалентен карбениев йон за CH5+.
История
През 1891 г. Г. Мерлинг съобщава, че е добавил бром към тропилиден (циклохептатриен) и след това е нагрял продукта, за да получи кристален, разтворим във вода материал, С
7H
7Br. Той не предлага структурата му, но Doering и Knox убедително показват, че това е тропилиенов (циклохептатриенов) бромид. Този йон е предвиден като ароматен по правилото на Хюкел.
През 1902 г. Норис и Керман независимо един от друг откриват, че безцветният трифенилметанол дава тъмножълти разтвори в концентрирана сярна киселина. Трифенилметилхлоридът също образува оранжеви комплекси с алуминиев и калаен хлорид. През 1902 г. Адолф фон Байер разпознава солевия характер на образуваните съединения.

Връзката между цвета и образуването на соли той нарича халохромия, чийто първообраз е малахитното зелено.
Карбокациите са реактивни междинни продукти в много органични реакции. Тази идея, предложена за първи път от Юлиус Щиглиц през 1899 г., е доразвита от Ханс Меервайн в неговото изследване от 1922 г. на пренареждането на Вагнер-Меервайн. Установено е също, че карбокатиони участват в реакциите NS1, E1 и в реакциите на пренареждане, като например пренареждането на Whitmore 1,2. Химическата наука не е склонна да приеме понятието карбокатион и дълго време Journal of the American Chemical Society отказва статии, в които те се споменават.
Първият ЯМР спектър на стабилен карбокатион в разтвор е публикуван от Doering et al. през 1958 г. Това е хептаметилбензониев йон, получен чрез третиране на хексаметилбензол с метилхлорид и алуминиев хлорид. Стабилният 7-норборнадиенов катион е получен от Story et al. през 1960 г. чрез реакция на норборнадиенов хлорид със сребърен тетрафлуороборат в серен диоксид при -80 °C. ЯМР спектърът установява, че той е некласически мост (първият наблюдаван стабилен некласически йон).
През 1962 г. Олах наблюдава директно терц-бутил карбокацията чрез ядреномагнитен резонанс като стабилен вид при разтваряне на терц-бутил флуорид в магическа киселина. ЯМР на норборниловия катион е докладван за пръв път от Schleyer и сътр. и е показано, че той претърпява протон-скрамбинг над бариера от Saunders и сътр.
Свойства
В органичната химия карбокатионът често е обект на нуклеофилна атака от страна на нуклеофили като хидроксилни (OH−) йони или халогенни йони.
Карбокациите се класифицират като първични, вторични или третични в зависимост от броя на въглеродните атоми, свързани с йонизирания въглерод. Първичните карбокации имат един или нула въглеродни атома, свързани с йонизирания въглерод, вторичните карбокации имат два въглеродни атома, свързани с йонизирания въглерод, а третичните карбокации имат три въглеродни атома, свързани с йонизирания въглерод.
Стабилността на карбокацията се увеличава с броя на алкилните групи, свързани с въглерода, носещ заряда. Третичните карбокации са по-стабилни (и се образуват по-лесно) от вторичните карбокации; първичните карбокации са силно нестабилни, тъй като, докато йонизираните въглероди от по-висок ред се стабилизират чрез хиперконюгация, то незаместените (първични) въглероди не са. Поради това реакции като реакцията NS1 и реакцията на елиминиране E1 обикновено не протичат, ако се образува първичен карбокатион. Изключение от това се случва, когато до йонизирания въглерод има двойна връзка въглерод-въглерод. Такива катиони като алиловия катион CH=CH-CH22+ и бензиловия катион6 CH-CH52+ са по-стабилни от повечето други карбокатиони. Молекулите, които могат да образуват алилови или бензилови карбокации, са особено реактивни.
Карбокатионите претърпяват реакции на пренареждане от по-малко стабилни структури към също толкова стабилни или по-стабилни структури с константи на скоростта, надвишаващи 10/s9. Този факт усложнява синтетичните пътища на много съединения. Например при нагряване на 3-пентанол с воден HCl първоначално образуваният 3-пентилов карбокатон се пренарежда до статистическа смес от 3-пентил и 2-пентил. Тези катиони реагират с хлоридния йон, като се получават около 1/3 3-хлорпентан и 2/3 2-хлорпентан.
Някои карбокатиони, като норборниловия катион, показват повече или по-малко симетрична трицентрова връзка. Подобни катиони се наричат некласически йони. Енергийната разлика между "класическите" карбокатиони и "некласическите" изомери често е много малка и обикновено има малка, ако изобщо има такава, енергия на активиране при прехода между "класическите" и "некласическите" структури. "Некласическата" форма на 2-бутиловия карбокатион по същество е 2-бутен с протон непосредствено над центъра на двойната връзка въглерод-въглерод. "Некласическите" карбокации някога са били предмет на големи спорове. Един от най-големите приноси на Джордж Ола към химията е разрешаването на този спор.
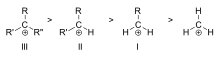
Ред на стабилност на примери за третични (III), вторични (II) и първични (I) алкилни карбокации
Специфични карбокатиони
Циклопропилкарбиниловите катиони могат да се изследват чрез ЯМР:

В ЯМР спектъра на диметилпроизводното се откриват два нееквивалентни сигнала за двете метилови групи, което показва, че молекулната конформация на този катион не е перпендикулярна (както в А), а е бисектрична (както в Б) с празната р-орбитала и циклопропиловата пръстенова система в една и съща равнина:

От гледна точка на теорията на огънатите връзки това предпочитание се обяснява с предположението за благоприятно орбитално припокриване между запълнените циклопропанови огънати връзки и празната р-орбитала.
Въпроси и отговори
В: Какво представлява карбокацията?
О: Карбокацията е йон с положително зареден въглероден атом.
В: Каква е външната валентна обвивка на карбокацията?
О: Външната валентна обвивка на карбокацията има само шест електрона вместо стабилните осем валентни електрона.
В: Защо карбокациите често са реактивни?
О: Карбокациите често са реактивни, защото се стремят да запълнят октета от валентни електрони, както и да възстановят неутралния си заряд.
В: Каква е максималната стабилност на въглеродните атоми?
О: Максималната стабилност на въглеродните атоми се постига, когато те имат осем валентни електрона.
В: Какво е секстет в химията?
О: Секстетът е термин, използван за описание на въглероден атом в карбокация, който има само шест електрона във външната си валентна обвивка вместо стабилните осем валентни електрона.
В: Каква е хибридизацията и молекулната геометрия на карбокация?
О: Въпреки че логиката подсказва, че карбокациите имат sp3 хибридизация с празна sp3 орбитала, която дава положителен заряд, тяхната реактивност повече наподобява sp2 хибридизация с тригонална равнинна молекулна геометрия.
Въпрос: Какво представлява правилото на октета?
О: Правилото на октета е принцип в химията, който гласи, че атомите са склонни да образуват химични връзки с други атоми, които позволяват и на двата атома да имат стабилен набор от осем валентни електрона.
обискирам