Челетропни реакции — перициклични процеси, при които един атом образува две връзки
Хелетропни реакции — перициклични механизми, при които един атом образува две връзки; примери, механизъм и приложение в органичната синтеза.
Челетропна реакция е вид перициклична реакция, при която един атом на един от реагентите образува две нови връзки едновременно. Перицикличната реакция представлява процес с преходно състояние, в което участва цикличен масив от атоми и съответстващ цикличен масив от взаимодействащи орбитали; в този цикъл се извършва координирана реорганизация на σ- и π-връзките. Челетропните реакции са частен подклас на циклоприсъединенията, но се отличават именно по факта, че двете нови връзки се формират към един и същи атом от едната страна на процеса.
Механизъм и характер
Типичната челетропна реакция протича конвергентно и концертно чрез циклично преходно състояние: един атом (например атом на карбен, серен или азотен център) взаимодейства едновременно с π-система и формира две σ-връзки. От гледна точка на теорията на молекулните орбитали, разрешеността и стереохимията на подобни реакции се определят от симетрията на участващите орбитали и от правилата на Woodward–Hoffmann за запазване на орбиталната симетрия. В някои случаи процесът може да протече стъпково (през радикални или йонни междинни продукти), особено ако е култивиран чрез катализатори или екстремни условия, но чистите челетропни реакции обичайно са конертни и без междинни стабилни видове.
Примери
- Добавяне на карбени към алкени: класически пример е присъединяването на свободен карбен (например :CH2 или :CCl2) към двойна връзка с образуване на циклопропан (двете нови връзки се формират към карбеновия въглерод).
- Хелетропни изтласквания (cheletropic extrusions): при тях в резултат на реакцията се отделя малка, стабилна молекула. Като примери са процеси, при които се отделя въглероден оксид (CO) или азотен газ (N2), а движещата сила често е ентропийната полза от освобождаването на газ.
- Реакции със серни оксиди: например формиране и обратно разграждане на производни на SO2 (сулфолени и др.), при които SO2 може да се присъедини или да се отдели чрез челетропен механизъм.
- Термолиза на азо-съединения: разграждането на някои азо-съединения с отделяне на N2 и образуване на карбени или други видове може да се разглежда като челетропна елиминация/екструзия.
Стереохимия и симетрия
Понеже при челетропните реакции двете връзки се образуват едновременно към един атом, стереохимичният изход зависи силно от подхода и ориентацията на взаимодействащите фрагменти. Ако процесът е супрафациален по отношение на π-системата и съответства на позволен орбитален коридор, реакцията протича бързо и с предвидим стереохимичен резултат. В някои случаи промяна на условията (термичен срещу фотохимичен процес или използване на метален каталитичен център) променя допустимите орбитални взаимодействия и следователно изхода.
Клинични и практични аспекти
Челетропните реакции имат важно приложение в синтеза: образуването на тричленни цикли (через карбеново присъединяване) е ценен метод за изграждане на напрегнати пръстени, а възможността за елиминация на малки молекули (CO, SO2, N2) прави тези реакции полезни и за деградиране/реорганизация на скелети в органичната химия. Освен това съвременните каталитични варианти (напр. метал-карбенови междинни продукти) позволяват по-добър контрол върху селективността и функционалностите.
Бележки и наблюдения
- В практиката е важно да се разграничи чистият челетропен механизъм от други процеси, които съставлено дават същите продукти, но чрез стъпкови или радикални пътища.
- Експериментални методи като кинетика, изотопно маркиране и квантово-химични пресмятания помагат за доказване на челетропния характер на дадена трансформация.
В резюме, челетропните реакции са специфична и полезна подгрупа на перицикличните процеси, характеризираща се с едновременна формиране (или разкъсване) на две връзки към един атом и с особености, диктувани от орбиталната симетрия и термодинамичните фактори (напр. освобождаване на газ).

Фигура 1. Перициклични реакции
Теоретичен анализ
Поради геометрията на молекулите, участващи в хелетропните реакции, те потвърждават редица предсказания, направени от теоретичните химици. Хелетропните реакции потвърждават запазването на симетрията на молекулните орбитали.
В перицикличното преходно състояние малка молекула предава два електрона на пръстена. Реакцията може да се обясни с две възможни геометрии. Малката молекула може да се приближи по линеен или нелинеен начин. При линейното приближаване електроните в орбитата на малката молекула са насочени директно към π системата на голямата молекула. При нелинейното приближаване орбитата се приближава под леко отклонен ъгъл. Способността на π-системата да се върти при приближаването на малката молекула е от решаващо значение за образуването на нови връзки. Посоката на въртене ще бъде различна в зависимост от това колко π-електрона има в системата. По-долу е показана схема на двуелектонен фрагмент, който се приближава към четириелектронна π-система, използвайки гранични молекулни орбитали. Въртенето ще бъде дистротационно, ако малката молекула се приближава линейно, и котротационно, ако молекулата се приближава нелинейно. Диспротаторните и конротаторните посочват как се въртят връзките в π-системата. Диспротаторни означава противоположни посоки, а котротаторни - една и съща посока. Това е показано и на схемата по-долу.
С помощта на правилото на Хукел може да се определи дали π-системата е ароматна или антиароматна. Ако е ароматен, при линейните подходи се използва дистротационно движение, а при нелинейните - котротационно движение. Обратното важи за антиароматна система. При линейните подходи ще се използва коротаторно движение, а при нелинейните - дистротаторно движение.
Хелетропни реакции, включващи SO2
Термодинамика
Когато серният диоксид реагира с бутадиен и изопрен, се получават два различни продукта. Механизмът на реакцията ще определи какво ще се получи. Възможни са както кинетичен, така и термодинамичен продукт. Получава се повече от термодинамичния продукт, отколкото от кинетичния продукт. Кинетичният продукт се получава при реакция на Диелс-Алдер, докато при хелетропна реакция се получава по-термодинамично стабилен продукт. Хелетропният път се използва повече, защото при него се получава по-стабилен адукт с петчленен пръстен. Схемата по-долу показва разликата между двата продукта. Пътят вляво показва термодинамичния продукт, а пътят вдясно - кинетичния продукт. Суарес и Сордо показват това през 1995 г. Те показаха това както с експерименти, така и с помощта на изчисления на Гаус.
Кинетика
Пример за това са хелетропните реакции на 1,3-диени със серен диоксид. Химиците са разгледали внимателно кинетиката на тази реакция. През 1976 г. Айзъкс и Лайла измерват кенетичните коефициенти за добавяне на серен диоксид към производни на бутадиен. Скоростите на добавяне са наблюдавани в бензол при 30 °C с първоначален двадесеткратен излишък на диен. Те са използвали спектрофотометър за изследване на светлината при 320 nm, за да измерят изчезването на SO2 . Реакцията показва "псевдокинетика от първи ред". Химиците установили, че групите, които отнемат електрони от диена, намаляват скоростта на реакцията. Освен това скоростта на реакцията се влияе значително от стеричните ефекти на 2-субституентите, като по-обемните групи увеличават скоростта на реакцията. (С други думи, колкото по-голяма е групата от атоми, висящи от втория въглероден атом, толкова по-бързо протича реакцията.) Авторите обясняват това с тенденцията обемистите групи да благоприятстват цизоидната конформация на диена, която е от съществено значение за реакцията (вж. таблицата по-долу). Освен това за седем от диените са измерени скоростите при четири температури. На базата на тези измервания химиците използват уравнението на Архениус, за да изчислят енталпията на активиране (ΔH‡ ) и ентропията на активиране (ΔS‡ ) за всяка реакция. Това е един от първите важни опити за изучаване на кенетиката на хелетропна реакция.
| -бутадиен | 104 k /min−1 (30 °C) (± 1-2%) абсолютна стойност | 104 k /min−1 (30 °C) (± 1-2%) относително | ΔH‡ /kcal mol−1 | ΔS‡ /cal mol−1 K−1 |
| 2-метил | 1.83 | 1.00 | 14.9 | -15 |
| 2-етил | 4.76 | 2.60 | 10.6 | -20 |
| 2-изопропил | 13.0 | 7.38 | 12.5 | -17 |
| 2-терт-бутил | 38.2 | 20.8 | 10.0 | -19 |
| 2-неопентил | 17.2 | 9.4 | 11.6 | -18 |
| 2-cloro | 0.24 | 0.13 | N/A | N/A |
| 2-бромоетил | 0.72 | 0.39 | N/A | N/A |
| 2-p-толил | 24.7 | 13.5 | 10.4 | -19 |
| 2-фенил | 17.3 | 9.45 | N/A | N/A |
| 2-(р-бромофенил) | 9.07 | 4.96 | N/A | N/A |
| 2,3-диметил | 3.54 | 1.93 | 12.3 | -18 |
| цис-1-метил | 0.18 | 0.10 | N/A | N/A |
| транс-1-метил | 0.69 | 0.38 | N/A | N/A |
| 1,2-диметилен-циклохексан | 24.7 | 13.5 | 11.4 | -16 |
| 2-метил-1,1,4,4-d4 | 1.96 | N/A | N/A | N/A |
През 2002 г. Monnat, Vogel и Sordo измерват кинетиката на добавяне на серен диоксид към 1,2-диметилиденциклоалкани. Те пишат, че реакцията на 1,2-диметилиденциклохексан със серен диоксид може да даде два различни продукта в зависимост от условията на реакцията. При кинетичен контрол (≤ -60 °C) реакцията води до получаването на съответния сулфин чрез хетеро-Дилс-Алдер реакция, но при термодинамичен контрол (≥ -40 °C) реакцията води до получаването на съответния сулфолен чрез хелетропна реакция. Еталпията на активиране за хетеро-Дилс-Алдеровата реакция е с около 2 kcal/mol по-малка от тази за съответната хелетропна реакция. Сулфоленът е с около 10 kcal/mol по-стабилен от изометричния султин в разтвор на CH2 Cl /SO22 .
Авторите са успели експериментално да изработят закон за скоростта при 261,2 К за реакцията на 1,2-диметилиденциклохексан със серен диоксид, при която се получава съответният сулфолен. Реакцията е от първи порядък за 1,2-диметилиденциклохексан, но от втори порядък за серен диоксид (вж. по-долу). Това потвърди предсказанието на химиците теоретици, основано на квантови изчисления на високо ниво ab initio. Използвайки изчислителни методи, авторите предложиха преходна структура за хелетропната реакция на 1,2-диметилиденциклохексан със серен диоксид (вж. фигурата вдясно). Реакцията е от втори порядък по отношение на серния диоксид, тъй като друга молекула серен диоксид вероятно се свързва с преходното състояние, за да го стабилизира. Подобни резултати са открити в изследване от 1995 г. на Suarez, Sordo и Sordo, в което са използвани ab initio изчисления за изследване на кинетичния и термодинамичния контрол на реакцията на серен диоксид с 1,3-диени.
Въздействие на разтворителите
Влиянието на разтворителя върху хелетропната реакция на 3,4-диметил-2,5-дихидротиофен-1,1-диоксид (показан вдясно) е кинетично изследвано в 14 разтворителя. Установено е, че константите на скоростта на реакцията в права и обратна посока, както и равновесните константи, са линейно свързани със скалата на полярността на разтворителя ET (30).
Реакциите се провеждат при 120 °C и се изследват чрез 1H-NMR спектроскопия на реакционната смес. Установено е, че скоростта на движение k1 намалява 4,5 пъти при преминаване от циклохексан към метанол. Установено е, че обратната скорост k-1 се увеличава 53 пъти при преминаване от циклохексан към метанол, докато равновесната константа Keq намалява 140 пъти. Предполага се, че има промяна на полярността по време на процеса на активиране, както се вижда от връзките между равновесните и кинетичните данни. Авторите казват, че реакцията изглежда се влияе от полярността на разтворителя и това може да се докаже от промяната в диполните моменти при преминаването от реагент към преходно състояние и към продукт. Авторите също така заявяват, че хелетропната реакция изглежда не се влияе нито от киселинността, нито от основността на разтворителя.
Резултатите от това проучване дават основание на авторите да очакват следното поведение:
1. Промяната в полярността на разтворителя ще повлияе на скоростта в по-малка степен, отколкото равновесието.
2. Константите на скоростта се характеризират с противоположен ефект на полярността: k1 леко намалява с увеличаването на ET (30), а k-1 се увеличава при същите условия.
3. Ефектът върху k-1 ще бъде по-голям, отколкото върху k1 .
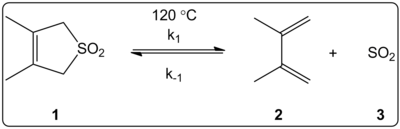
Изследване на хелетропната реакция в различни разтворители

Предложено преходно състояние за реакция на 1,2-диметилиденциклохексан със SO2 за получаване на сулфолен чрез хелетропична реакция

Реакция на 1,2-диметилиденциклохексан със SO2 , при която се получава султин чрез хетеро-диелс-Алдерова реакция под кинетичен контрол или сулфолен чрез хелетропна реакция под термодинамичен контрол
Карбенови добавки към алкени
Една от най-важните от синтетична гледна точка хелетропни реакции е добавянето на синглетен карбен към алкен, за да се получи циклопропан (вж. фигурата вляво). Карбенът е неутрална молекула, съдържаща двувалентен въглерод с шест електрона във валентната си обвивка. Поради това карбените са силно реактивни електрофили и се образуват като междинни продукти на реакцията. Синглетният карбен съдържа празна p орбитала и приблизително sp2 хибридна орбитала, която има два електрона. Синглетните карбени се добавят стереоспецифично към алкени, а стереохимията на алкена се запазва в циклопропановия продукт. Механизмът за добавяне на карбен към алкен е съгласувано [2+1] циклоприсъединяване (вж. фигурата). Карбени, получени от хлороформ или бромоформ, могат да се използват за добавяне на CX2 към алкен, за да се получи дихалоциклопропан, докато реактивът на Simmons-Smith добавя CH2 .
Взаимодействието на запълнената карбенова орбитала с π-системата на алкена създава четириелектронна система и благоприятства нелинейния подход. Благоприятно е също така смесването на празната р орбитала на карбена с напълнената π орбитала на алкена. Благоприятното смесване става чрез нелинеен подход (вж. фигура 2 вдясно). Въпреки това, макар че теорията ясно благоприятства нелинейния подход, няма очевидни експериментални последици за линейния спрямо нелинейния подход.

Фигура 2. А) Орбитали за единични карбени Б) Нелинеен подход на а) орбитала на карбена sp2 и б) орбитала на карбена p

Добавяне на карбен към алкен за образуване на циклопропан
Въпроси и отговори
В: Какво представлява чийзкейк реакцията?
О: Хелетропната реакция е вид перициклична реакция, при която един атом на един от реагентите получава две нови връзки.
В: Какво представлява перицикличната реакция?
О: Перицикличната реакция е реакция, която включва преходно състояние с цикличен масив от атоми и свързан с него цикличен масив от взаимодействащи орбитали, при което има реорганизация на връзките َ и ً.
В: По какво се различава от другите видове реакции?
О: Хелетропните реакции са подклас на циклоприсъединенията и това, което ги отличава от другите видове реакции, е, че при единия от реагентите двете нови връзки се осъществяват към един и същ атом.
В: Какви са някои примери?
О: Примерите включват "хелетропни изтласквания", като например когато единичният атом в карбонилната група се оказва във въглероден оксид.
В: Какво стимулира тези реакции?
О.: Движещата сила на тези реакции често е ентропийната полза от освобождаването на газ (напр. CO или N2).
В: Свързана ли е фигура 1 с хелетропните реакции? О: Да, на фигура 1 са показани примери за хелетропни реакции.
обискирам
![{\displaystyle {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}](https://www.alegsaonline.com/image/a02f69dd0783356fbf24499f57d0df29cd264f16.svg)