Конротаторни и дистротаторни електроциклични реакции — определение
Конротаторни и дистротаторни електроциклични реакции — ясно обяснение на механизмите, орбиталната симетрия и правилата на Удуърд–Хофман с примери и илюстрации.
Конротационен и дистротационен описват два начина, по които се извършват електроцикличните реакции — вид електроциклични реакции в рамките на органичната органични химични реакции). При конротационния режим заместителите, разположени в краищата на конюгирана система от двойни връзки, се въртят в една и съща посока (или и двете по часовниковата стрелка, или и двете обратно на нея) по време на отварянето или затварянето на пръстена. При дистротационния режим крайните орбитали се въртят в противоположни посоки.
Какво определя режима — орбитална симетрия
Ключът е в симетрията на най-високо заетата молекулна орбитала (HOMO) на линейната (отворена) конюгирана система. За да се образува нова σ-връзка при затварянето на пръстен, фазите (знаците) на крайните пи-орбитали трябва да се подредят по определен начин. Ако фазите в HOMO изискват крайните орбитали да се въртят в противоположни посоки, реакцията е дистротационна; ако изискват едновременно въртене в една и съща посока, реакцията е конротационна.
Правила за броя на π-електроните и типа на стимула
- Термични (термални) електроциклични реакции:
- Ако системата има 4n + 2 π-електрона (Hückel-стабилна, напр. 6 π e−), то затварянето/отворянето е стереоспецифично и обикновено следва дистротационен режим.
- Ако системата има 4n π-електрона (напр. 4 или 8 π e−), реакцията обикновено е конротационна.
- Фотоиндуцирани (светлинно активирани) електроциклични реакции:
- Правилата се обръщат — 4n + 2 системи предпочитат конротация, а 4n системи — дистротация.
Пример
Класически пример е превръщането на транс-цис-транс-2,4,6-октатриен в цис-диметилциклохексадиен. Този октатриен има 6 π-електрона (4n + 2, с n = 1), затова орбиталната механика на термичната реакция изисква дистротационен режим — крайните пи-орбитали се въртят в противоположни посоки, за да се получи правилната симетрия на образуващата се σ-връзка в цикличния продукт. По този начин се запазва орбиталната симетрия, което обяснява и стереоспецифичността на процеса.

Практически последици и обобщение
Поради запазването на орбиталната симетрия, електроцикличните реакции са стереоспецифични — ориентацията на заместителите в продукта е предопределена от режима (конротация или дистротация). Тези правила се формулират и обобщават от Правилата на Удуърд–Хофман, които позволяват да се предскаже стереохимията на електроцикличните трансформации въз основа на броя на π-електроните и дали процесът е термичен или фотохимичен.
По-долу илюстрацията показва разликата между конротационните и дистротационните механизми и как въртенето на краищата на конюгираната система влияе върху крайната стереохимия на продукта.
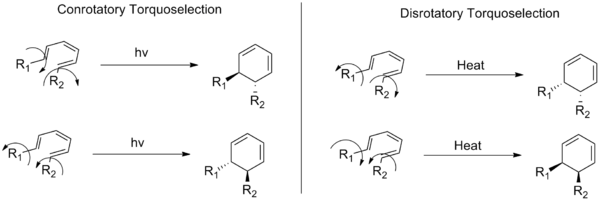
Конротаторни и дистротаторни режими на въртене, всеки от които показва две възможни посоки на въртене, които водят до двойки енантиомери за обща хексатриенова система.
Въпроси и отговори
В: Какво представлява електроцикличната реакция?
О: Електроцикличната реакция е вид органична химична реакция, при която конюгирана система от двойни връзки се отваря или затваря, за да образува пръстен.
В: Каква е разликата между конротаторните и дистротаторните режими?
О.: При конротаторния режим заместителите, разположени в краищата на конюгираната система от двойни връзки, се движат в една и съща посока (по посока на часовниковата стрелка или обратно на нея) по време на отварянето или затварянето на пръстена. За разлика от това, при дистротаторния режим те се движат в противоположни посоки.
Въпрос: Как орбиталната симетрия влияе на тези реакции?
О: Орбиталната механика на реакцията трябва да се вземе предвид, когато се определя дали тя следва коротаторни или дистротаторни правила. Например системите, съдържащи 4n + 2 пи електрона, са стереоспецифични и следват коротаторното правило поради запазването на орбиталната симетрия в най-високо заетите им молекулни орбитали (HOMO). Системите, съдържащи 4n пи електрона, показват обратния дистротационен режим. Това е вярно и за пренарежданията на 4n + 2 pi (където n е цяло число) електрона, предизвикани от светлина (фотоиндуцирани). Фотоиндуцираните пренареждания на системи с 4n пи електрона (където броят на електроните е делим на 4) следват дистротационното правило.
Въпрос: Какво представляват правилата на Удуърд-Хофман?
О: Правилата на Удуърд-Хофман обобщават различните видове електроциклични реакции и как те се влияят от фактори като орбитална симетрия и наличие/отсъствие на светлинна енергия.
В: Какво показва тази снимка?
О: Картинката показва пример за преобразуване от транс-цис-транс-2,4,6-октатриен в цис-диметилциклохексадиен и илюстрира как заместителите се движат по различен начин в зависимост от това дали следват коноротарен или дистроротарен режим - съответно по посока на часовниковата стрелка срещу посока, обратна на часовниковата стрелка, когато се гледа отгоре.
обискирам