Генотерапия (генна терапия): как работи, вектори и Glybera
Генотерапия (генна терапия): как работи, вектори и Glybera — научете за вирусните вектори, механизма, ползите и рисковете при възстановяване на увредени гени.
Генотерапията означава вкарване на работещ ген в организма на човек, който има увреден ген. Европейската комисия е одобрила този метод за едно конкретно лечение. При лечението с продукта Glybera се използва вирус за заразяване на мускулни клетки с работещо копие на гена. Европейската комисия е издала разрешение за пускане на пазара на Glybera, което означава, че той може да се продава в целия ЕС.
Как работи генотерапията
Целта на генотерапията е да замени липсващ или дефектен ген с функционално копие, да добави нов ген, който да помага на клетките да работят правилно, или да премахне/потисне вредно генетично действие. В общи линии има два основни подхода:
- Соматична генотерапия — генетичните промени се правят в телесни клетки (не в яйцеклетки или сперма) и не се предават на следващите поколения. Това е основният и етично приемлив подход при лечение на болести при хора.
- Герминална генна терапия — промените засягат полови клетки и биха се предавали на потомството; в повечето държави това е забранено за клинична употреба при хора поради етични и безопасностни причини.
Вектори и начини на доставяне
Когато се използва по този начин, вирусът е вектор. Това означава, че той е носител; генът е вмъкнат във вирусния геном и вирусът го вкарва в човешките клетки. Векторите са променени така, че да не могат да се размножават и да причиняват болест, но запазват способността да доставят генетичния материал.
Има два основни вида вектори и методи:
- Вирусни вектори — най-често използваните включват адено-асоциирани вируси (AAV), аденовируси и лентивируси. Всеки има предимства и недостатъци:
- AAV: често предпочитан за еднократни инжекции (например в ретината или нервната тъкан), има по-ниска имуногенност и обикновено не интегрира в човешкия геном (по-малък риск от промени в ДНК), но капацитетът му за вмъкване на генетичен материал е ограничен.
- Адeновируси: могат да носят по-големи гени и да дават силна експресия, но предизвикват по-силен имунен отговор.
- Лентивируси: интегрират генетичния материал в генома и осигуряват дълготрайна експресия — използват се често при екз виво подходи (напр. модифициране на клетки извън тялото и връщането им обратно), но има риск от инсерционна мутагенеза.
- Невирусни методи — плазмиди, липидни наночастици (използвани при модерен mRNA подход), електропорация и др. Те обикновено имат по-ниска ефективност на доставяне, но по-малък риск от вирусни реакции и интеграция в генома.
Терминология: когато се използва вирус за доставка на ген, правилният термин е трансдукция. Терминът трансфекция обикновено се използва за вкарване на ДНК или РНК в клетки с невирусни методи. Тази техника се различава от техниките за нокаутиране на гени, при които обикновено не се използва вирусен вектор, а се използват методи като CRISPR/Cas за таргетно премахване или промяна на гени.
Пример: Glybera
Един на всеки милион души има увредени копия на гена липаза, необходим за разграждането на мазнините. При наследствен дефицит на липопротеинова липаза (LPLD) мазнините се натрупват в кръвта и това води до болка и възпаление на панкреаса (панкреатит), което може да бъде животозастрашаващо. Досега единственият начин за справяне със състоянието беше строга диета с много ниско съдържание на мазнини и симптоматично лечение.
Glybera беше първата генна терапия, одобрена от Европейската комисия за лечение на наследствен дефицит на липопротеинова липаза. Терапията използваше AAV (серотип 1), за да достави функциониращ ген за липаза директно в мускулни клетки чрез серия инжекции в мускулите. Целта беше пациентът да получи постоянно или дълготрайно производство на липаза в мускулите, което да намали броя и тежестта на панкреатитите.
Важно е да се отбележи, че Glybera беше изтеглена от пазара няколко години след одобрението поради комерсиални причини — силно висока цена (в редици от порядъка на около милион евро на пациент) и много ограничен брой пациенти, които да я използват. В следствие на това в момента лекарството вече не е на разположение в търговската мрежа, но остава важен исторически пример за потенциала и предизвикателствата на генната терапия.
Рискове и ограничения
- Имунен отговор: тялото може да разпознае векторите и да развие имунитет, който намалява ефективността или причинява възпалителни реакции.
- Инсерционна мутагенеза: при интегриращи вектори (напр. някои ретровируси/лентивируси) вмъкване в генома може да активира онкогени и да доведе до онкологични усложнения — историята на експериментални терапии по детския SCID демонстрираше такъв риск.
- Краткотрайност на експресията: при някои вектори и при делящи се клетки ефектът може да избледнее с времето и да бъде необходима повторна терапия, което е свързано с допълнителни рискове и предизвикателства.
- Странични ефекти и токсичност: включително местни реакции, системни възпалителни реакции и, при високи дози, органна токсичност.
- Етични и социални въпроси: достъпност, висока цена, приоритизация на рядко срещани болести и опасения относно потенциалното злоупотреба с техниките за модификация на човешкото наследство.
Регулация, клинични изпитвания и бъдеще
Генната терапия се регулира строго — разрешение за клинични изпитвания и за пускане на пазара се дава от национални и международни регулаторни органи (като Европейската комисия/EMA). Пациентите преминават през фази I–III клинични изпитвания, които оценяват безопасността и ефективността. След одобрение продължава мониторинг за дългосрочни ефекти.
През последните години бяха одобрени няколко други генно-терапевтични продукта и клетки-основни терапии (напр. терапии за наследствени нарушения на зрението, спинална мускулна атрофия, някои имунни и онкологични заболявания). Изследванията продължават, а технологиите за доставка (по-добри вектори, липидни наночастици) и за прецизно редактиране на генома (напр. CRISPR-базирани подходи) напредват бързо.
Какво да очакваме като пациент или роднина
- Генотерапията може да предложи лечение в случаи, където преди това е нямало ефективна опция, но не е без рискове.
- Обсъдете с генетик и специалист по болестта възможностите, клиничните изпитвания и дългосрочните последици.
- Информирано съгласие, проследяване и регистри на пациенти са ключови за безопасността и оценката на ползите в дългосрочен план.
Генотерапията остава една от най-обещаващите, но и най-сложните области на съвременната медицина. Тя комбинира генетика, вирусология, имунология и клинична практика и изисква балансиран подход между надеждата за лечение и вниманието към безопасността, етиката и справедливия достъп до терапиите.
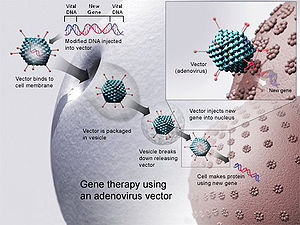
Генна терапия с помощта на аденовирусен вектор. Нов ген се поставя във вирус, който след това се поставя в човек. Ако лечението е успешно, новият ген ще създаде работещ ензим, който ще лекува болестта.
Китай
През 2003 г. Китай е първата страна, която одобрява търговското производство на генна терапия. Тази генна терапия е за плоскоклетъчен карцином на главата и шията (HNSCC) - рак, който се среща в 10% от новите случаи на рак в Китай. Всяка година в Китай има 2,5 милиона нови пациенти с рак.
Първата в света търговска генна терапия, продавана под търговското наименование Gendicine, също използва вирус за вмъкване на гена в човешкия геном.
Минало
За възможността за генна терапия се заговори веднага след като се разбра за ролята на ДНК и РНК. Първата конкретна публикация е от 1972 г.
Бъдеще
Много други видове генна терапия са в процес на изпитване. Ясно е, че цикълът от събития ще бъде част от бъдещата клинична медицина: Анализ на ДНК последователността > идентифициране на дефектни гени > поправяне на гените с генна терапия или изключване на гени. Понякога има проблеми със странични ефекти; те могат да бъдат открити на етапа на изпитване. Вече има база данни, в която са изброени всички известни клинични изпитвания.
Въпроси и отговори
В: Какво представлява генната терапия?
О: Генната терапия е процесът на вмъкване на работещ ген, който да замени увреден ген в пациента.
В: Какъв продукт е одобрен от Европейската комисия за генна терапия?
О: Европейската комисия е одобрила продукта Glybera за генна терапия.
В: Как Glybera лекува генетичното заболяване?
О: Glybera използва вирус, за да зарази мускулните клетки с работещо копие на гена за лечение на генетичното разстройство.
В: Какво представлява генът липаза и защо е важен?
О: Генът липаза е ген, необходим за разграждането на мазнините. Той е важен, тъй като увредените копия на гена могат да причинят натрупване на мазнини в кръвта, което води до панкреатит, който е животозастрашаващ.
В: Каква техника използва Glybera за генна терапия?
О: Glybera използва техниката на трансфекция, при която вирусният вектор вкарва гена в човешки клетки.
В: Какво представлява вирусният вектор?
О: Вирусният вектор е носител, който пренася генетичен материал в клетките.
В: По какво техниката на трансфекция се различава от техниката на генно изключване?
О: Техниката на трансфекция включва използването на вирусен вектор за вмъкване на работно копие на гена, докато техниката на генно нокаутиране не използва вирусен вектор. Целта на техниката за нокаутиране на гени е да се премахне или обезсили даден ген.
обискирам