Осмоза: принцип, осмотично налягане и роля в клетките
Осмоза: как работи осмотичното налягане и ролята му в клетките — ясно обяснение на процеса, значение за водния баланс, тургора и мембранната пропускливост.
Осмозата (/ɒzˈmoʊ.sɪs/) е движение на молекули на разтворител (течност) през мембрана от един разтвор в друг, което става без външна сила.
Разтворителят ще се придвижи към страната с по-висока концентрация на разтворени частици и следователно с по-ниска концентрация на разтворител. Това се случва, защото мембраната е селективно пропусклива: разтворителят може да премине през нея, но разтвореното вещество не може. Молекулите на разтворителя се движат произволно и така концентрациите от двете страни стават по-равномерни. В крайна сметка системата достига осмотично равновесие, при което няма нетно преместване на разтворителя.
Осмотично налягане и количествена оценка
Осмозата може да бъде накарана да върши работа. Осмотичното налягане е външното налягане, което трябва да се приложи, за да няма нетно движение на разтворител през мембраната. За разтвор на идеален разтвор това налягане се доближено описва от уравнението на ван 'т Хоф:
Π = i · C · R · T
където Π е осмотичното налягане, i е ван 'т Хофовият коефициент (брой на частиците, получени от разтворителя при дисоциация), C е моларната концентрация на разтвореното вещество, R е универсалната газова константа, а T е абсолютната температура (в келвини). Така осмотичното налягане е колигативно свойство — зависи от броя на частиците в разтвора, а не толкова от тяхната химична природа. На практика при високи концентрации или при разтвори с йони се появяват отклонения от идеалното поведение.
Фактори, влияещи върху осмозата
- Концентрация на разтворените частици — по-голяма концентрация води до по-голямо осмотично налягане.
- Температура — повишаването ѝ увеличава осмотичното налягане (според уравнението на ван 'т Хоф).
- Проницаемост на мембраната — от размера на порите, полярността и присъствието на транспортащи белтъци (например аквапорини).
- Електролитна дисоциация — йонизацията на разтворените вещества променя ефективния брой частици (i).
- Наличие на непроникващи или частично проникващи йони — може да възникнат допълнителни ефекти като Донаново равновесие.
Осмоза в клетките и организми
Осмозата е ключов механизъм за водния баланс в биологичните системи, тъй като клетъчните мембрани са полупропускливи. По принцип тези мембрани са непропускливи за големи молекули, като йони, протеини и полизахариди. Те са пропускливи за неполярни или хидрофобни молекули като липиди и малки молекули като кислород, въглероден диоксид, азот и азотен оксид. Пропускливостта зависи от разтворимостта, заряда или химичния състав, както и от размера на разтвореното вещество. Водните молекули преминават през плазмената мембрана, вакуолата или протопласта чрез дифузия през фосфолипидния бислой и през специализирани канали — аквапорини.
В зависимост от относителните концентрации на разтворени вещества клетъчната среда може да бъде:
- Изотонична — няма значима промяна във водния поток; клетката запазва обема си.
- Хипотонична — външната среда е с по-ниска концентрация на разтворени вещества; вода влиза в клетката и тя може да се напука (в животински клетки) или да стане тургорна (в растителни клетки благодарение на клетъчната стена).
- Хипертонична — външната среда е по-концентрирана; вода излиза от клетката, което води до смаляване, плазмолиза у растителните клетки или схващане/скършване (crenation) у животинските клетки.
Клетките често регулират своя осмотичен баланс активно чрез йонни помпи и транспортни протеини — например Na+/K+-АТФаза при животните, които променят концентрациите на разтворимите частици и така контролират осмотичното налягане. При растенията вакуолата играе важна роля за съхраняване на разтворени вещества и поддържане на тургора.
Специални белтъци: аквапорини
Аквапорините са мембранни белтъци, които формират специализирани канали за бърз трансфер на вода през мембраната. Те ускоряват осмотичното равновесие и позволяват клетките бързо да отговорят на промени в средата. Липсата или нарушената функция на аквапорини може да доведе до проблеми в регулирането на водния баланс (напр. бъбречни заболявания при хората).
Приложения и технологични процеси
- Обратна осмоза — процес, при който чрез прилагане на външно налягане по-голямо от осмотичното, вода се принуждава да премине през полупропусклива мембрана от концентриран към разреден разтвор. Използва се за опресняване на морска вода, пречистване на питейна вода и в индустриални процеси.
- Мембранна диализа и медицински апарати — принципи, свързани с осмоза и дифузия, намират приложение при диализа и контрол на електролитния баланс.
- Хранително-вкусова индустрия — контрол на влажността, осмотична дехидратация, съхранение.
- Изследвания в биологията и фармацията — измерване на осмотично налягане, изследване на транспорт през мембрани.
Ограничения и особености
Реалните системи често се отклоняват от идеалния модел: концентрирани разтвори, електролити и свързани молекули променят ефективното осмотично налягане. Също така, някои мембрани са частично пропускливи за определени йони, което може да доведе до електрически потенциали (Донанов ефект) и нееднозначни водни потоци. Освен това структурни дефекти в мембраната или наличието на канални белтъци силно влияят върху кинетиката на осмозата.
Осмозата е фундаментален физико-химичен процес с широки биологични и технологични значение — от поддържане на живота в клетките до пречистване на води и инженерни приложения.
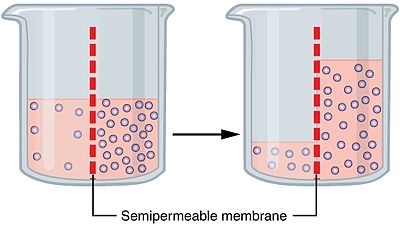
Процесът на осмоза през полупропусклива мембрана. Сините точки представляват частици, които движат осмотичния градиент
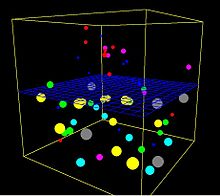
Това е кадър от триизмерна компютърна симулация на процеса на осмоза. Синята мрежа е непропусклива за по-големите топчета, но по-малките могат да преминат през нея. Всички топчета подскачат наоколо
Хипотонични, изотонични и хипертонични
Разтворите могат да съдържат повече или по-малко разтворено вещество на единица разтворител. Разтворът с по-малко количество се нарича хипотоничен. Когато двата разтвора са с еднаква концентрация, те са изотонични. Разтворът с по-голямо съдържание е хипертоничен. Когато хипотоничният разтвор е извън клетката, а хипертоничният - вътре в нея, клетката се раздува и изкривява.
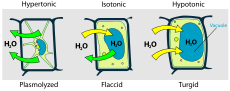
Растителна клетка в различни среди
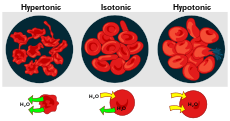
Влияние на различни разтвори върху кръвните клетки
Клетъчни мембрани
Плазмената мембрана на клетката е полупропусклива, което означава, че позволява навлизането на определени молекули навътре или навън. Тя позволява преминаването на малки молекули, но блокира по-големи молекули. Мембраната има и портове или вратички, през които преминават определени макромолекули. Това е активен транспорт, който използва енергия и е селективен. Тя е най-външната обвивка на животинската клетка, изградена от протеини и липиди. Пример: обмен на газове като кислород и въглероден диоксид.
Свързани страници
- Обратна осмоза
- Осморегулация
Въпроси и отговори
В: Какво представлява осмозата?
О: Осмозата е движение на молекули на разтворител (течност) през мембрана от един разтвор в друг без външна сила. Разтворителят ще се придвижи към страната с по-висока концентрация на разтворени вещества и по-ниска концентрация на разтворител.
В: Как действа осмозата?
О: Осмозата работи, защото мембраната е селективно пропусклива и позволява преминаването на разтворителя, но не и на разтвореното вещество. Молекулите на разтворителя се движат произволно и така концентрациите от двете страни стават по-равни. Може да се приложи осмотично налягане, така че да няма нетно движение на разтворител през мембраната.
Въпрос: Кои фактори влияят върху пропускливостта на биологичните мембрани?
О: Пропускливостта на биологичните мембрани зависи от разтворимостта, заряда или химичния състав, както и от размера на разтвореното вещество.
В: Как водните молекули преминават през биологичните мембрани?
О: Водните молекули преминават през биологичните мембрани, като дифундират през фосфолипидния бислой.
В: Каква роля играе осмозата в живите системи?
О: В живите системи осмозата осигурява начин за навлизане на вода в клетките и излизането ѝ от тях и помага за поддържане на тургорното налягане в клетките, като създава равновесие между вътрешността на клетката и околната среда.
В: Как моларната концентрация влияе на осмотичното налягане?
О: Осмотичното налягане зависи от моларната концентрация на разтвореното вещество; по-високите концентрации изискват по-голямо външно налягане, за да няма нетно движение на разтворителя през мембраната.
обискирам