Алотропи на въглерода: диамант, графит, свойства и приложения
Алотропи на въглерода: диамант и графит — свойства, твърдост, проводимост и приложения в бижута и индустрията. Научете как структурата диктува функцията.
Съществуват няколко алотропа на въглерода. Най-известните са диамантът и графитът. Графитът е проводник, полуметал (елемент, който е отчасти метал и неметал, например черен фосфор и сив селен). Той може да се използва например като материал в електродите на електрическа дъгова лампа. Графитът е най-стабилната форма на твърд въглерод, откривана някога.
Какво означава алотропия
Алотропите са различни форми на един и същ химичен елемент. Всички елементи са съставени от уникални собствени атоми. Всички физически разлики се дължат на начина, по който атомите са свързани помежду си. При много елементи се наблюдава алотропия, тъй като има редица начини, по които атомите могат да бъдат свързани помежду си. Също така има различни начини, по които молекулите могат да бъдат подредени, за да се получат по-големи структури.
Структури и химични връзки
Основната причина за различните свойства на алотропите на въглерода е видът на химичните връзки между атомите на въглерода:
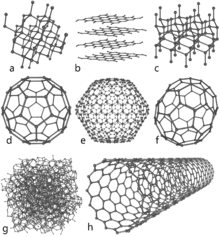
- В диаманта всеки атом въглерод е свързан с четири други атома чрез sp3 хибридизирани връзки, образувайки триизмерна решетка от тетраедрични клетки. Това дава изключителна механична здравина и твърдост.
- В графита всяка молекула въглерод е sp2 хибридизирана и образува плоски шестоъгълни листове; връзките в равнината са силни ковалентни, а слоевете са свързани с по-слаби ван дер Ваалсови сили, което прави слоевете лесно плъзгащи се един върху друг и придава смазващи свойства.
- Има и други форми: графен (еднослоен графит), фулерен (сферични молекули като C60), въглеродни нанотръби (цилиндрични слоеве графен) и аморфен въглерод (като графитен въглен, сажди). Всички те показват различни електрически, оптични и механични свойства заради различната подредба на атомите.
Диамант: свойства и приложения
Диамантът е един от най-известните алотропи на въглерода. Твърдостта му и високото разсейване на светлината го правят подходящ за използване в бижута. Той има и индустриални приложения. Диамантът е най-твърдият известен естествен минерал. Това го прави отличен абразив. Диамантът също така запазва добре блясъка си. И диамантът, и графитът имат изключително висока температура на топене, което е необичайно за неметален елемент.
Допълнителни характеристики и приложения на диаманта:
- Много висока топлопроводимост — използва се в топлоразсейващи елементи и като материал за радиатори в микроелектрониката.
- Електрическа изолация — чистият диамант е изолатор, но легиран или дефектен диамант може да бъде полупроводников.
- Индустриални приложения — рязане, смилане и пробиване (свредла и режещи ръбове с диамантено покритие), оптични прозорци и лабораторни високо натискови клетки (диамантени наковалници).
- Синтетично производство — диаманти се отглеждат чрез методи като високо налягане/висока температура (HPHT) и химическо отлагане от газова фаза (CVD), които позволяват контрол върху чистотата и размера за специфични приложения.
Графит: свойства и приложения
Графитът е добър проводник на електричество в равнината на слоевете поради наличието на делокализирани електрони. Това го прави подходящ за електроди и електрически компоненти — например като материал в електродите на електрическа дъгова лампа. Благодарение на ниското триене между слоевете, графитът се използва и като смазочен материал и като сухо смазка в механични системи.
Допълнителни характеристики и приложения на графита:
- Висока термична устойчивост — използва се в инертни нагреваеми компоненти и тунинговани високотемпературни приложения.
- Композиционни материали — графитните влакна и графитовите електроди са важни в електро- и металургичната промишленост.
- Основен материал за производството на графен — еднослоен графит с уникални електрически и механични свойства, перспективен за микроелектроника и сензори.
Други алотропи и форми на въглерода
Освен диамант и графит, има още няколко важни форми:
- Графен — еднослоен двумерен лист от въглеродни атоми, с изключителна здравина и висока електронна подвижност.
- Фулерен (напр. C60) — молекули с кълбовидна форма, използвани в нанотехнологии и като модификатори на материали.
- Въглеродни нанотръби — цилиндрични структури с висока якост и електрическа проводимост; обещаващи за усилване на композитни материали и за електронни устройства.
- Аморфен въглерод — включва въглен, сажа и въглерод в стъклоподобно състояние; използва се при филтри, адсорбенти и в пигменти.
Произход и стабилност
Графитът е термодинамично най-стабилната форма на въглерода при стандартни условия, докато диамантът е метастабилна форма — той е стабилен кинетично (разграждането му в графит е изключително бавно при нормална температура), но при много високи температури и определени условия диамантът може да се превърне в графит. Въглеродът има високи температури на сублимиране/топене в зависимост от налягането и средата; това е необичайно за неметал, но следствие от силните ковалентни връзки.
Обобщение
Алотропите на въглерода демонстрират как една и съща химична основа (въглеродни атоми) може да даде материал с напълно различни свойства в зависимост от геометрията и вида на връзките между атомите. От бляскавия и изключително твърд диамант до плоските, проводими слоеве на графита. Другите форми като графен, фулерените и нанотръбите добавят допълнителни функционални възможности и откриват полета за нови технологии и индустриални приложения.
size=0.56
Въпроси и отговори
В: Какви са алотропите на въглерода?
О: Алотропите на въглерода са различни форми на един и същ химичен елемент.
В: Кои са най-известните алотропи на въглерода?
О: Най-известните алотропи на въглерода са диамантът и графитът.
В: Какво представлява графитът и какви са неговите свойства?
О: Графитът е полуметал и добър проводник. Той е и най-стабилната форма на твърд въглерод, откривана някога.
В: Какво представляват алотропите?
О: Алотропите са различни форми на един и същ химичен елемент.
В: Защо различните елементи се характеризират с алотропия?
О: Много елементи показват алотропия, тъй като има редица начини, по които атомите могат да бъдат свързани помежду си.
В: Какво представлява диамантът и какви са неговите свойства?
О: Диамантът е един от най-известните алотропи на въглерода. Твърдостта му и високото разсейване на светлината го правят подходящ за използване в бижута. Той е и най-твърдият известен естествен минерал.
В: Каква е температурата на топене на диаманта и графита?
О: И диамантът, и графитът имат изключително високи температури на топене, което е необичайно за неметален елемент.
обискирам