Термохимия: енергия, топлина и термодинамика на химичните реакции
Термохимия: разбиране на енергията, топлината и термодинамиката в химичните реакции — енталпия, ентропия, спонтанност и точни изчисления за реакции и преобразувания.
Термохимията е наука за енергията и топлината, свързани с химичните реакции и физичните преобразувания (физични промени). Физичните трансформации са, когато едно състояние на материята (например твърдо или течно) се променя в друго. Примери за преобразувания са топенето (когато твърдо вещество се превръща в течност) и кипенето (когато течност се превръща в газ).
Реакцията отдава или приема енергия. Физическата трансформация също отдава или приема енергия. Термохимията разглежда тези енергийни промени, по-специално енергийния обмен на дадена система със заобикалящата я среда. Термохимията е полезна за прогнозиране на количествата на реагентите и продуктите по всяко време на дадена реакция. Термохимиците правят това, като използват данни, включително определяне на ентропията. Термохимиците ще кажат дали дадена реакция е спонтанна или неспонтанна, благоприятна или неблагоприятна.
При ендотермичните реакции се отделя топлина. При екзотермичните реакции се отделя топлина. Термохимията съчетава понятията на термодинамиката с идеята за енергията под формата на химични връзки. Тя включва изчисления на такива величини като топлинен капацитет, топлина на горене, топлина на образуване, енталпия, ентропия, свободна енергия и калории.
Забележка за ендотермични и екзотермични процеси
Важно: въпреки че горният текст съдържа вътрешни връзки, които могат да изглеждат объркващо, правилните определения са следните: при ендотермичните процеси системата абсорбира топлина от околната среда (q > 0), а при екзотермичните процеси системата отдава топлина към околната среда (q < 0). Примери: стопяване на лед е ендотермичен процес; горенето на дърво е екзотермичен процес.
Основни понятия
- Система и заобикаляща среда: системата е частта от вселената, която изучаваме; всичко останало е заобикаляща среда.
- Видове системи: отворена (обменя вещество и енергия), затворена (обменя енергия, но не вещество), изолирана (не обменя нито енергия, нито вещество).
- Топлина (q) и работа (w): два начина за пренос на енергия между система и околност. По дефиниция положителна q означава топлина, приета от системата.
- Първи закон на термодинамиката: ΔU = q + w, където ΔU е промяната на вътрешната енергия на системата.
- Енталпия (H): H = U + pV; при постоянен натиск промяната на енталпията ΔH е равна на топлината, обменена с околната среда: q_p = ΔH.
Енталпия, ентропия и свободна енергия
Енталпия (ΔH) описва топлинния ефект при реакция при постоянен натиск. Стандартната енталпия на образуване (ΔHf°) се използва за пресмятане на енталпийни промени на реакции чрез уравнение: ΔH°_реакция = ΣΔHf°(продукти) − ΣΔHf°(реагенти).
Ентропия (ΔS) е мярка за степента на разпределение на енергията и "разреденост" на системата. Вторият закон гласи, че сумарната промяна на ентропията на вселената (система + околност) при спонтанен процес е положителна: ΔS_univ = ΔS_sys + ΔS_surr > 0.
Гибсова свободна енергия (ΔG) свързва енталпията и ентропията: ΔG = ΔH − TΔS. При дадена температура T процесът е спонтанен, ако ΔG < 0; когато ΔG = 0 — системата е в равновесие.
Термохимични изчисления и принципи
- Функции на състоянието и пътни функции: ΔH, ΔU, ΔS са функции на състоянието — зависят само от началното и крайното състояние, не от пътя. Топлината и работата сами по себе си са пътни функции.
- Закон на Хес: енталпийният ефект на цяла реакция е сбор от енталпийните ефекти на стъпките, от които е сглобена реакцията. Това позволява изчисления чрез стандартни енталпии на образуване или чрез таблични стойности.
- Стандартни условия: често се използва стандартна температура 298,15 K (25 °C) и налягане 1 bar; стойностите обозначаваме със знак °, напр. ΔH°f.
Калориметрия — как се измерва топлината
Калориметрията е експериментален метод за измерване на количеството топлина, обменяно при химични реакции или физични промени.
- Постоянно налягане (coffee‑cup) калориметър: използва се за реакциите в разтвор при атмосферно налягане; измерва се ΔT и q_p = m c ΔT, където m е масата на разтвора, c — специфичната топлина.
- Бомов калориметър (постоянен обем): използва се за измерване на топлината на горене; при постоянен обем q_v = ΔU (не ΔH), но от резултатите може да се пресметне ΔH при познато pΔV.
Формула за топлинна промяна: q = m c ΔT. Специфична топлина c е количеството топлина, необходимо за повишаване на температурата на единица маса с 1 °C. Моларният топлинен капацитет C_m е топлинният капацитет за 1 мол.
Единици и практични бележки
- Основната SI единица за енергия е джоул (J). Често срещана историческа единица е калорията (cal): 1 cal = 4.184 J.
- Топлинните ефекти на реакции са пропорционални на количеството вещество — винаги посочвайте за какво количество реагенти продуктите са дадени (например per mol реакция).
- В практическите изчисления в термохимията е важно да се следят знаците: положително ΔH означава, че системата е погълнала топлина (ендотермичен), отрицателно ΔH — отделила е топлина (екзотермичен).
Примери и приложения
- Изчисляване на топлина на горене за горива (полезно в енергетиката и инженерството).
- Оценка на спонтанността на реакции в химична синтеза чрез ΔG и ΔS (важно за катализа, биохимия и материалознание).
- Определяне на термодинамични свойства чрез калориметрични експерименти (лабораторни упражнения и промишлен контрол).
Термохимията свързва практическите измервания (калориметрия) с фундаменталните закони на термодинамиката, което позволява да се предвижда и контролира енергията при химични и физични промени — от лабораторни реакции до промишлени процеси и биологични системи.
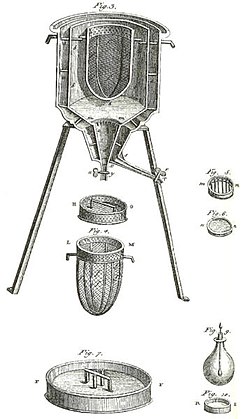
Първият в света леден калориметър, използван през зимата на 1782-83 г. от Антоан Лавоазие и Пиер-Симон Лаплас. Той е използван за определяне на топлината, отделяна при различни химични промени. Тези изчисления се основават на по-ранното откритие на Жозеф Блек за латентната топлина. Тези експерименти поставят началото на термохимията.
История
Термохимията започва с две идеи:
- Лавоазие и законът на Лаплас (1780 г.): Енергийното изменение при всяко преобразуване е равно и противоположно на енергийното изменение при обратния процес.
- Закон на Хес (1840 г.): Промяната на енергията при всяко преобразуване е една и съща, независимо дали то се извършва на една или на много стъпки.
Тези открития са направени преди първия закон на термодинамиката (1845 г.). Те помагат на учените да разберат този закон.
Едуард Диас и Хес изследват специфичната топлина и латентната топлина. Джоузеф Блек разработва концепцията за промени в латентната енергия.
Густав Кирхоф показва през 1858 г., че промяната в топлината на реакцията се определя от разликата в топлинния капацитет на продуктите и реактивите: ∂ Δ H ∂ T = Δ C p {\displaystyle {{\partial \Delta H} \над \частично Т}=\Delta C_{p}} 
Калориметрия
Измерването на топлинните промени се нарича калориметрия. С нея се измерва топлината на химичните реакции или физичните промени. Калориметърът, уредът за калориметрия, обикновено представлява затворена камера.
Калориметрията се състои от следните етапи: Химиците извършват промяната в камерата. Температурата на камерата се измерва с помощта на термометър или термодвойка. Температурата се съпоставя с времето, за да се получи графика. Химиците използват графиката, за да изчислят основните величини.
Съвременните калориметри разполагат с малки компютри, които измерват температурата и бързо дават изчислените данни. Пример за това е диференциалният сканиращ калориметър (DSC).
Системи
Няколко термодинамични дефиниции са много полезни в термохимията. "Система" е конкретният участък от Вселената, който се изследва. Всичко извън системата се счита за околна среда. Една система може да бъде:
- изолирана система - когато не може да обменя енергия или материя със заобикалящата я среда, както е при изолирания калориметър на бомба;
- затворена система - когато може да обменя енергия, но не и материя със заобикалящата я среда, както е при парния радиатор;
- отворена система - когато може да обменя както материя, така и енергия със заобикалящата я среда, например тенджера с вряща вода.
Процеси
Една система преминава през "процес", когато едно или повече от нейните свойства (характеристики) се променят. Процесът е свързан (свързва се) с промяната на състоянието. Изотермичен (с една и съща температура) процес се случва, когато температурата на системата остава една и съща. Изобарен (при едно и също налягане) процес се случва, когато налягането на системата остава едно и също. Адиабатен (без топлообмен) процес се случва, когато няма движение на топлина.
Свързани страници
- Важни публикации в областта на термохимията
- Изодезична реакция
- Принцип на максимална работа
- Реакционен калориметър
- Принцип на Томсен-Бертело
- Юлиус Томсен
- Термодинамични бази данни за чисти вещества
- Калориметрия
- Топлинна физика
Въпроси и отговори
В: Какво представлява термохимията?
О: Термохимията е наука за енергията и топлината, свързани с химичните реакции и физичните преобразувания.
В: Какви са някои примери за физични преобразувания?
О: Примери за физични преобразувания са топенето (когато твърдо вещество се превръща в течност) и кипенето (когато течност се превръща в течност).
В: Как термохимията помага да се предскажат количествата на реагентите и продуктите?
О: Термохимиците използват данни, включително определяне на ентропията, за да предскажат количествата на реагиращите вещества и продуктите по всяко време на дадена реакция.
В: Ендотермичните реакции благоприятни или неблагоприятни са?
О: Ендотермичните реакции са неблагоприятни.
В: Екзотермичните реакции благоприятни или неблагоприятни са?
О: Екзотермичните реакции са благоприятни.
В: Какви понятия съчетава термохимията?
О: Термохимията съчетава понятията на термодинамиката с идеята за енергията под формата на химични връзки.
В: Какви видове изчисления правят термохимиците?
О: Термохимиците правят изчисления като топлинен капацитет, топлина на горене, топлина на образуване, енталпия, ентропия, свободна енергия и калории.
обискирам