Втори закон на термодинамиката: ентропия, формулировки и приложения
Втори закон на термодинамиката: ясно обяснение на ентропията, формулировките на Клаузиус и Келвин и практични приложения в наука, инженерство и енергетика.
Вторият закон на термодинамиката формулира едно от основните ограничения върху преобразуванията на енергия и върху посоката на естествените процеси: когато енергията преминава от една форма в друга или материята се движи свободно, ентропията (често наричана „мярка за безпорядък“ или „мярка за разпределение на енергията“) в затворена система като правило се увеличава. Това означава, че енергийните градиенти (напр. температурни разлики), които могат да извършват работа, имат склонност да се изглаждат с времето.
Какво е ентропия?
Ентропията е величина, която описва колко широко е разпределена енергията или колко голям е броят на възможните микроскопични състояния, които съответстват на едно макроскопично състояние. Приближение от статистическата механика (Болцман) дава формулата
S = k ln W,
където S е ентропията, k е константата на Болцман (≈ 1.380649·10^−23 J/K), а W е броят на микроскопичните конфигурации (състояния), съвместими с даденото макроскопично състояние. За термодинамични системи ентропията има единици джоули на келвин (J/K).
Формулировки на втория закон
Най-разпространената формулировка на втория закон се дължи на Рудолф Клаузиус и гласи, че в изолирана система ентропията никога не намалява — тя или остава постоянна при обратими (идеални) процеси, или се увеличава при необратими процеси. По практичен начин това може да се изрази и чрез споменатия по-долу закон за топлопреминаването.
Топлината не може сама по себе си да премине от по-студено към по-топло тяло.
Еквивалентното твърдение на лорд Келвин е:
Невъзможно е преобразуване, чийто единствен краен резултат е превръщането на топлина, извлечена от източник при постоянна температура, в работа.
Двете формулировки (Клаузиус и Келвин) са математически и концептуално еквивалентни и описват едно и също фундаментално ограничение: не може да се построи вечен двигател от втори род, който да преобразува цялата топлина в полезна работа без допълнителни ефекти.
Математични изрази
За термодинамичен процес във връзка с топлина и температура съществува диференциална форма:
dS ≥ δQ/T,
където δQ е добавената към системата топлина, T — абсолютната температура при която се обменя топлината, а равенството важи само за обратими процеси. За изолирана система (δQ = 0) следва:
dS ≥ 0 — ентропията на затворена изолирана система не намалява.
Примери и следствия
- Ако поставите горещо тяло до студено, топлината ще тече от горещото към студеното, докато температурите не се изравнят — това е директна последица от втория закон.
- Топлинните двигатели (напр. парни турбини) не могат да имат 100% ефективност. За цикъл на Карно максималната ефективност е η = 1 − T_c/T_h, където T_h и T_c са температурите на горещия и студения резервоар (в Келвин).
- Рефрижераторът или климатикът пренася топлина от по-студена към по-топла област, но за това е необходима външна работа — съгласно Клаузиус, топлината не може сама да премине „нагоре“ по температурна градиентова стълба.
- Спонтанно разбъркване и дифузия: ако се пусне разделител между две газови области, молекулите се смесват и ентропията на общата система нараства.
- В гравитационно поле вертикалните разлики в плътност и налягане могат да се поддържат: разликите в температурата, налягането и плътността обикновено се изравняват хоризонтално след известно време, но заради гравитацията плътността и налягането не се изравняват вертикално — плътността и налягането на дъното ще бъдат по-големи, отколкото на върха.
Приложения
- Проектиране и оптимизация на топлинни машини, охлаждащи системи и енергийни процеси.
- Разбиране на временната посока на процесите в космологията и еволюцията на Вселената (стрелата на времето).
- Информационни науки: чрез формули като Гибсова ентропия S = −k Σ p_i ln p_i се свързва вероятностното описание на информационната неизвестност с термодинамичната ентропия.
- Биология и екология: живите системи поддържат порядък локално, но за това обменят енергия и увеличават ентропията на околната среда — няма противоречие със втория закон.
Статистическата природа и ограничени случаи
Вторият закон е вероятностен закон: той описва типичното (макроскопично) поведение на системи с огромен брой частици. За много малки системи или при кратки времеви скали могат да се наблюдават флуктуации, при които локално и временно ентропията намалява. За макроскопични системи тези флуктуации са практически невъзможни (вероятността е експоненциално малка).
Пример за предизвикателство към интуицията е парадоксът на Максвел (Maxwell’s demon) — въображаемо същество, което селективно позволява преминаване на бързи молекули в една страна и бавни в друга, изглеждащо намалява ентропията без работа. Решението на парадокса използва понятия от теория на информацията: записът и изтриването на информация от „демона“ водят до енергийни разходи, които компенсират намаляването на ентропията (принципът на Ландауер).
Ограничения и уточнения
- Вторият закон важи за затворени или изолирани системи. В отворени системи (които обменят енергия и материя с околната среда) ентропията на самата система може да намалее, но общата ентропия на системата плюс околната среда не намалява.
- Законът е валиден класически и квантово-механично; при квантови системи понятието ентропия се обобщава чрез ентропията на фон Нойман: S = −k Tr(ρ ln ρ), където ρ е плътностният матричен оператор.
Заключение
Вторият закон на термодинамиката е фундаментален принцип, който определя посоката на естествените процеси, ограничава преобразуването на енергия и свързва макроскопичните наблюдения с микроскопичната статистика. Той обяснява защо температурата се стреми да се изравни, защо перфектните вечни двигатели от втори род са невъзможни, и защо почти всички процеси в природата са в известен смисъл необратими.
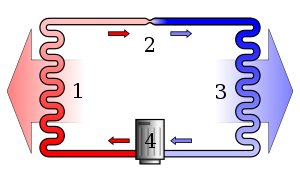
Опростена стилизирана схема на хладилния цикъл на термопомпа с парокомпресия: 1) кондензатор, 2) разширителен клапан, 3) изпарител, 4) компресор.
Преглед
В общ смисъл вторият закон гласи, че температурните разлики между системите, които са в контакт една с друга, имат тенденция да се изравняват и че от тези неравновесни разлики може да се получи работа, но че при извършване на работа и увеличаване на ентропията се губи топлинна енергия. Разликите в налягането, плътността и температурата в една изолирана система се стремят да се изравнят, ако им се даде възможност; плътността и налягането, но не и температурата, се влияят от гравитацията. Топлинният двигател е механично устройство, което осигурява полезна работа от разликата в температурата на две тела.
Цитати
| “ | Законът, че ентропията винаги се увеличава, според мен заема първостепенно място сред природните закони. Ако някой ви посочи, че вашата любима теория за Вселената е в противоречие с уравненията на Максуел - толкова по-зле за уравненията на Максуел. Ако се окаже, че тя противоречи на наблюденията - е, тези експериментатори понякога се объркват. Но ако се окаже, че теорията ви противоречи на втория закон на термодинамиката, не мога да ви дам никаква надежда; не ѝ остава нищо друго, освен да рухне в най-дълбоко унижение. | ” |
Сър Артър Стенли Едингтън, "Природата на физическия свят" (1927 г.)
| “ | Тенденцията за увеличаване на ентропията в изолираните системи е изразена във втория закон на термодинамиката - може би най-песимистичната и аморална формулировка в цялата човешка мисъл. | ” |
-Грег Хил и Кери Торнли, Principia Discordia (1965 г.)
| “ | Съществуват почти толкова формулировки на втория закон, колкото са и дискусиите по него. | ” |
-философ/физик П.У. Бриджман, (1941)
Различни
- Фландърс и Суон създават музикална версия на втория закон на термодинамиката, наречена "Първи и втори закон.
- Икономистът Николас Джорджеску-Роген показва значението на закона за ентропията в областта на икономиката (вж. неговия труд The Entropy Law and the Economic Process (1971), Harvard University Press).
Въпроси и отговори
В: Какво представлява вторият закон на термодинамиката?
О: Вторият закон на термодинамиката гласи, че когато енергията преминава от една форма в друга или материята се движи свободно, ентропията (безпорядъкът) в затворена система се увеличава.
В: Какво има тенденция да се изравнява хоризонтално с течение на времето?
О: Разликите в температурата, налягането и плътността се изравняват хоризонтално след известно време.
В: Защо плътността и налягането не се изравняват вертикално?
О: Поради силата на гравитацията плътността и налягането не се изравняват вертикално. Плътността и налягането в долната част са по-големи, отколкото в горната.
В: Какво е ентропия?
О: Ентропията е мярка за разпространението на материята и енергията навсякъде, където те имат достъп.
В: Каква е най-често срещаната формулировка на втория закон на термодинамиката?
О: Най-разпространената формулировка на втория закон на термодинамиката се дължи основно на Рудолф Клаузиус: всичко се опитва да поддържа една и съща температура във времето.
В: Кое е друго твърдение на Клаузиус относно втория закон на термодинамиката?
О: Друго твърдение на Клаузиус е, че топлината не може сама по себе си да премине от по-студено към по-топло тяло.
В: За какъв вид система се прилага вторият закон на термодинамиката?
О: Вторият закон на термодинамиката се прилага само за големи системи, в които не влиза и не излиза енергия или материя. Колкото по-голяма е системата, толкова по-вероятно е вторият закон да е верен.
обискирам