Батерия — устройство за преобразуване на химическа в електрическа енергия
Научете как батерията преобразува химическа в електрическа енергия, видове (първични/вторични), зареждане, употреба в мобилни устройства и електромобили и съхранение/рециклиране.
Батерията преобразува химическата енергия в електрическа чрез химическа реакция. Вътре в батерията са разположени материали (електроди и електролит), които участват в тази реакция. Батерията се използва във верига за захранване на други компоненти и обикновено доставя електричество с постоянен ток (ток, който тече в една посока). Това я прави подходяща за много електронни устройства и преносими уреди.
Как работи
В основата на работата на батерията е движение на йони и електрони: в една електродна двойка (анод и катод) се случват окислително-възстановителни реакции. Електролитът позволява на йоните да преминават между електродите, а електроните текат по външната верига, захранвайки свързаното устройство. Тъй като електроните не могат да преминат през електролита, те минават през външния товар и така се генерира електрическа енергия.
Основни части на батерията
- Анод (отрицателен електрод) — отдава електрони при разреждане.
- Катод (положителен електрод) — приема електрони при разреждане.
- Електролит — среда, по която се движат йоните.
- Сепаратор — материал, който разделя анода и катода, но позволява преминаването на йони.
- Клетка/корпус и клеми — механична защита и контакти за свързване във веригата.
Видове батерии
Батериите могат да бъдат първични или вторични. Първичните (еднократна употреба) се използват до изчерпване и след това се изхвърлят. Типични примери са алкалните батерии AA/AAA. Вторичните (презареждаеми) могат да се зареждат многократно — например акумулатори за електрически превозни средства, мобилни телефони и преносими компютри.
Често срещани химии:
- Алкални (за еднократна употреба) — евтини и с дълъг срок на съхранение.
- Литиево-йонни (Li-ion) — висока енергийна плътност, широко използвани в телефони и електромобили.
- Оловно-киселинни — евтини и подходящи за стартови и стационарни приложения (например резервно захранване).
- Никел-метал-хидридни (NiMH) — презареждаеми алтернативи на алкалните в някои приложения.
- Никел-кадмиеви (NiCd) — по-рядко поради проблеми с паметния ефект и токсичността на кадмия.
Ключови характеристики
- Номинално напрежение (V) — напрежението на една клетка (напр. ~1.5 V за алкални, ~3.6–3.7 V за Li-ion).
- Капацитет (mAh или Ah) — колко заряд може да съхранява; по-голям капацитет означава по-дълго време на работа.
- Енергийна плътност — енергия на единица маса или обем; важна за преносими устройства и електромобили.
- Вътрешно съпротивление — влияе на възможността за доставка на висока мощност и на загряване при натоварване.
- Живот на цикли — колко зареждания/разреждания може да понесе батерията до значителна загуба на капацитет.
- Саморазреждане — скоростта, с която батерията губи заряд в покой.
Съединяване на клетки
За да се постигне по-високо напрежение или по-голям капацитет клетки се свързват в серия или паралел:
- В серия — напреженията се сумират (например 2 x 3.7 V = 7.4 V).
- В паралел — капацитетите се сумират, напрежението остава същото.
Приложения
В домашни условия използването на електричество от контакт в сграда е по-евтино и по-ефективно, но батерията може да осигури електричество в райони, в които няма електроразпределение. Тя е полезна и за неща, които се движат, като например електрически превозни средства и мобилни телефони. Батерии се използват също в аварийни източници на захранване, преносима електроника, сензори, дистанционни устройства и много други.
Зареждане и поддръжка
- Различните химии изискват различни методи на зареждане (напр. Li-ion — режим CC-CV: постоянен ток, следван от постоянен напрежение).
- Избягвайте дълбоко разреждане и продължително презареждане — това намалява живота на батерията.
- Температурата влияе силно: високи температури ускоряват деградацията, много ниски намаляват ефективността.
- За дългосрочно съхранение съхранявайте батериите на прохладно и сухо място с частичен заряд (в зависимост от типа).
Безопасност и опазване на околната среда
Батериите съдържат химикали и при неправилно боравене могат да предизвикат пожари, изтичане или токсично замърсяване. Някои важни правила:
- Не късо съединявайте клемите — това може да предизвика искрене и пожар.
- Не изгаряйте батерии и не ги разрязвайте; някои съдържат опасни материали.
- Рециклирайте батериите и акумулаторите на специализирани пунктове — това намалява замърсяването и позволява повторно използване на материали.
- При транспортиране на големи/литиеви батерии спазвайте регулаторните изисквания за опаковане и маркиране.
Практически съвети за потребителя
- Избирайте батерия с подходяща химия и капацитет за устройството и начина на употреба.
- При презареждащи се батерии използвайте правилното зарядно устройство и следете температурата по време на зареждане.
- При плануване на автономно захранване или за резервни системи вземете предвид енергийна плътност, живот на цикли и безопасност.
- Проверявайте рекциклираните програми за акумулатори във вашия район и предавайте изхабените батерии за обработка.
Обобщение: Батерията е удобно и често необходимо средство за преобразуване на химическа в електрическа енергия. Разбирането на нейното устройство, видове, характеристики и правилна експлоатация помага за по-безопасна и ефективна употреба, както и за намаляване на въздействието върху околната среда.

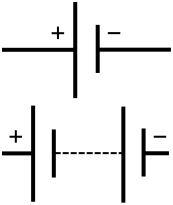
Схематичен символ на батерия
Химическият състав на батерията
Батерията може да бъде с една или с много клетки. Всяка клетка има анод, катод и електролит. Електролитът е основният материал в батерията. Той често е вид киселина и може да бъде опасен при допир. Анодът реагира с електролита, за да произведе електрони (това е отрицателният или - край). Катодът реагира с електролита и приема електрони (това е положителният или + край). Електрическият ток възниква, когато проводник свързва анода с катода и електроните се движат от единия край към другия. (Но една батерия може да се повреди само от проводник, свързващ двата края, затова е необходим и товар между двата края. Товарът е нещо, което забавя електроните и обикновено прави нещо полезно, като например крушка във фенерче или електроника в калкулатор).Електролитът може да бъде течен или твърд. В зависимост от вида на електролита батерията се нарича батерия с мокри или сухи клетки.
Химичните реакции, които протичат в батерията, са екзотермични. При този тип реакции се отделя топлина. Например, ако оставите лаптопа си включен за дълго време и след това докоснете батерията, тя ще бъде топла или гореща.
Акумулаторната батерия се зарежда чрез обръщане на химическата реакция, която протича в батерията. Но акумулаторната батерия може да се зарежда само определен брой пъти (живот на зареждане). Дори вградените батерии не могат да се зареждат вечно. Освен това всеки път, когато батерията се презарежда, нейната способност да задържа заряд намалява малко. Непрезареждаемите батерии не трябва да се зареждат, тъй като от тях могат да изтекат различни вредни вещества, например калиев хидроксид.
Клетките могат да бъдат свързани, за да се получи по-голяма батерия. Свързването на положителния елемент на една клетка с отрицателния на следващата се нарича последователно свързване. Напреженията на всяка батерия се събират. Две последователно свързани батерии с напрежение 6 волта ще създадат напрежение 12 волта.
Свързването на положителния елемент на едната клетка с положителния елемент на другата и на отрицателния с отрицателния се нарича паралелно свързване. Напрежението остава същото, но токът се събира. Напрежението е налягането, което изтласква електроните през проводниците, и се измерва във волтове. Токът е колко електрона могат да преминат наведнъж, измерва се в ампери. Комбинацията от тока и напрежението е мощността (ватове = волтажи х ампери) на батерията.
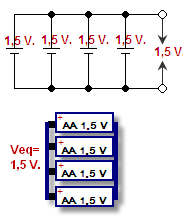
Батерии, свързани паралелно - показано на схема и чертеж
Размери на батериите
Батериите се предлагат в много различни форми, размери и напрежения.АА, ААА, С и D клетките, включително алкалните батерии, са със стандартни размери и форми и имат напрежение около 1,5 волта. Напрежението на една клетка зависи от използваните химикали. Електрическият заряд, който тя може да осигури, зависи от това колко голяма е клетката, както и от това какви химикали. Зарядът, който батерията осигурява, обикновено се измерва в амперчасове. Тъй като напрежението остава едно и също, по-голям заряд означава, че по-голяма клетка може да осигури повече ампери или да работи по-дълго време.
История
Първата батерия е изобретена през 1800 от Алесандро Волта. В наши дни неговата батерия се нарича волтова батерия.В малките съвременни батерии течността е обездвижена в нещо като паста и всичко е поставено в запечатан корпус. Благодарение на този корпус нищо не може да се излее от батерията. По-големите батерии, като например автомобилните, все още имат течност вътре и не са запечатани. По време на Втората световна война е изобретен вид акумулатор, който използва разтопени соли като електролит.
Видове батерии
- Сухи клетки, клетки, които не съдържат течност (или съдържат имобилизирана течност като паста или гел) като електролит.
- Първична клетка, клетки, които не могат да бъдат презареждани
- Алкална батерия, "алкална", без възможност за презареждане
- Живачна батерия, която не може да се презарежда
- Батерия Leclanche, "супер тежка", не се презарежда
- Литиева батерия, която не може да се презарежда, "монетна клетка"
- Батерия от сребърен оксид, неакумулаторна, батерия за часовник
- Волтаична купчина, първата батерия на Алесандро Волтас
- Вторична клетка, клетки, които могат да се зареждат
- Запечатана оловно-киселинна батерия
- Литиево-йонна батерия, презареждаща се, използвана в мобилни телефони и лаптопи
- Никел-кадмиева батерия, "NiCd", презареждаща се
- Никел-металхидридна батерия, "NiMH", презареждаща се
- Никел-цинкова батерия
- Мокри клетки - клетки, които съдържат течност като електролит.
- Оловно-киселинна батерия, акумулаторна, автомобилна батерия
- Никелово-желязна батерия, акумулаторна, батерия Едисон
- Горивна клетка, която се зарежда чрез добавяне на гориво

Изглед отгоре на автомобилна батерия
Алтернативи на батерии
Горивните и слънчевите клетки не са батерии, защото не съхраняват енергията в тях.Кондензаторът не е батерия, защото не съхранява енергията от химическа реакция. Кондензаторът може да съхранява електроенергия и да създава електроенергия много по-бързо от батерията, но обикновено струва твърде скъпо, за да бъде направен толкова голям, колкото може да бъде батерията. Учените и инженерите-химици работят за създаването на по-добри кондензатори и батерии за електрически автомобили.
Малките електрически генератори, които се управляват с ръка или крак, могат да захранват малки електрически устройства. Радиоприемниците с часовников механизъм, факлите с часовников механизъм и други подобни устройства също имат навиваща се пружина за съхраняване на механична енергия.
Въпроси и отговори
В: Какво представлява батерията?
О: Батерията е устройство, което преобразува химическата енергия в електрическа чрез химическа реакция.
В: Как батерията произвежда електричество?
А: Батерията произвежда постоянен ток (DC), който тече в една посока и не се превключва напред-назад.
В: Къде се съхраняват химикалите в батерията?
О: Обикновено химикалите се съхраняват вътре в батерията.
В: Каква е разликата между първична и вторична батерия?
О: Първичната батерия се изхвърля, когато вече не може да осигурява електричество, докато вторичната батерия може да се зарежда и използва повторно.
В: Защо батериите са полезни?
О: Батериите са полезни за осигуряване на електроенергия в райони, в които няма електроразпределение, и за неща, които се движат, като например електрически превозни средства и мобилни телефони.
В: По-евтино и по-ефективно ли е използването на електричество от контакт в сграда, отколкото използването на батерия?
О: Да, използването на електричество от контакт в сграда е по-евтино и по-ефективно от използването на батерия.
В: Какъв вид електроенергия произвежда батерията?
О: Батерията произвежда електричество с постоянен ток (DC).
обискирам