Изолобална аналогия в органометалната химия — определение и приложения
Изучете изолобалната аналогия в органометалната химия — определение, принципи HOMO/LUMO, примери и приложения за предсказване на реактивност и свързване, с ключови случаи от Роалд Хофман
Принципът на изолобала (известен още като изолобална аналогия) е полезен концептуален инструмент за предсказване и разбиране на свойствата на връзките на органометалните съединения. В органометалната химия той свързва структурата и реактивността на органични фрагменти и лиганди, които се свързват с неорганични молекулни фрагменти. Роалд Хофман формулира идеята по такъв начин, че два молекулни фрагмента да се считат за изолобални "ако броят, симетричните свойства, приблизителната енергия и формата на граничните орбитали и броят на електроните в тях са сходни — не идентични, но сходни". Това позволява предвиждане на свързването и реактивността на по-малко известни фрагменти от поведението на по-добре познати такива, когато двата имат сходни гранични орбитали — най-високата заета молекулна орбитала (HOMO) и най-ниската незаета молекулна орбитала (LUMO). Изолобалните съединения са аналози на изоелектронните съединения, които споделят един и същ брой валентни електрони и структура. Графично представяне на изолобалните структури, като изолобалните двойки са свързани чрез двуглава стрелка с половин орбитала отдолу, се намира на фигура 1.
Концепцията дава прост, прозрачен начин за сравнение между органични и метални фрагменти. Често срещано приложение е да се разглеждат органични радикали, йони или молекулни парчета и техни съответстващи метални еквиваленти — при които броят и характерът на фронталните орбитали (наричани още "лобове") кореспондират. Това подпомага:
- предсказване на геометрии и типове връзки в органометални комплекси;
- разбиране на механизми на каталитични реакции, например кои фрагменти могат да мигрират или да участват в оксидативни/редуктивни стъпки;
- проектиране на нови лигандни заместители и заместващи стратегии при синтез на комплекси;
- интерпретация на класификацията на клъстери и нарастващи структури чрез заместване на органични звена с метални фрагменти и обратно.
Как да се прилага изолобалната аналогия
При практическо използване на принципа обикновено се следват няколко стъпки:
- Определя се броят на валентните електрони и броят на фронталните орбитали на всеки фрагмент.
- Сравняват се симетрията и формата на HOMO/LUMO (или на други гранични орбитали), за да се оцени сходството.
- Ако параметрите са сходни, се прави прогноза за начина на свързване и възможните реакции, като се има предвид, че енергетичните различия могат да модифицират поведението.
- Комбинира се с експериментални данни или с квантово-химични изчисления (напр. DFT) за по-точна оценка.
Примери и илюстрации
Илюстративни (и често цитирани) сравнения включват връзки между органични радикали, йони или неутрални фрагменти и техни метални аналози — например когато един метиленов или метилов фрагмент се сравнява с метален център, който притежава аналогичен брой фронтални орбитали и съответния електронен брой. Тези сравнителни примери помагат да се предвидят възможни типове свързване (σ- vs. π-връзки), както и склонността към формиране на мостови връзки в клъстери. В литературата често се показват диаграми на гранични орбитали, които да пояснят защо два първоначално различни химични фрагмента могат да имат сходно химическо поведение.
Ограничения и предупреждения
Хофман уточнява, че изолобалната аналогия е полезен, но опростен модел. Тя не винаги дава правилни предсказания, защото:
- не отчитa всички енергетични разлики между орбиталите на различните елементи и лигандни среди;
- игнорират се стереохимични и стерични ефекти, които често определят реалната геометрия и реактивност;
- не включва динамични солвентни или кинетични фактори, които могат да променят механизма на реакцията;
- заодоляване на ограниченията изисква подкрепа от експериментални наблюдения и модерни квантово-химични изчисления.
За работата си по аналогия с изолобала Хофман получава Нобелова награда за химия през 1981 г., която споделя с Кеничи Фукуи. В лекцията си за Нобеловата награда Хофман подчертава, че изолобалната аналогия е полезен, но прост модел. В някои случаи той се проваля и затова е важно идеята да се използва като насока, а не като абсолютен закон — винаги в комбинация с другите инструменти на съвременната химия.
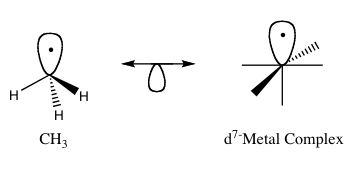
Фигура 1: Основен пример за аналогия на изолобата.
Въпроси и отговори
В: Какво представлява принципът на изолобата?
О: Принципът на изолобал (известен също като изолобална аналогия) е начин за предсказване на свойствата на връзките на органометалните съединения. Той свързва структурата на органичните лиганди, които могат да се свързват с неорганични молекулни фрагменти, като сравнява най-високата им заета молекулна орбитала (HOMO) и най-ниската незаета молекулна орбитала (LUMO).
Въпрос: Кой е предложил принципа на изолобата?
О: Роалд Хофман предлага принципа на изолобата.
В: Как се отнася той към изоелектронните съединения?
О: Изолобалните съединения са аналози на изоелектронните съединения, които имат един и същ брой валентни електрони и еднаква структура.
В: Какво е получил Хофман за работата си по тази концепция?
О: За работата си по аналогия с изолобалите Хофман получава Нобелова награда за химия през 1981 г., която споделя с Кеничи Фукуи.
В: Как Хофман описва молекулните фрагменти?
О: Хофман описва молекулните фрагменти като изолобални, "ако броят, симетричните свойства, приблизителната енергия и формата на граничните орбитали и броят на електроните в тях са сходни - не идентични, но сходни".
Въпрос: Как се използва този модел, за да се предскаже свързването и реактивността?
О: Може да се предскаже свързването и реактивността на по-малко известни части от тази на по-известни части, ако те имат сходни гранични орбитали.
В: Винаги ли този модел работи правилно?
О: Не, в някои случаи той не успява.
обискирам