Изотопи на водорода: протий, деутерий, тритий и редки нестабилни форми
Научете всичко за изотопите на водорода — протий, деутерий, тритий и редките нестабилни форми, тяхната природа, свойства и приложения.
Водородът има три основни изотопа: протий (1H), деутерий (2H) и тритий (3H). Тези изотопи се образуват естествено в природата. Протият и деутерият са стабилни. Тритият е радиоактивен и има период на полуразпад от около 12 години. Учените са създали четири други изотопа на водорода (4H to 7H), но тези изотопи са много нестабилни и не съществуват в природата.
Основните изотопи на водорода са уникални, тъй като са единствените изотопи, които имат име. Тези имена се използват и днес. Понякога деутерият и тритият получават свои собствени символи - D и T. Международният съюз по чиста и приложна химия обаче не харесва много тези имена, въпреки че те често се използват. Има и други изотопи, които са имали свои собствени имена, когато учените са изучавали радиоактивността. Но днес техните имена вече не се използват.
Атомна структура и маси
Разликата между изотопите е броят на неутроните в ядрото. Протият (1H) има само един протон и няма неутрони. Деутерият (2H) има един протон и един неутрон. Тритият (3H) има един протон и два неутрона. Това води до различни маси и физични свойства: масите (атомни масови единици) са приблизително 1.0078 u за 1H, 2.0141 u за 2H и 3.0160 u за 3H.
Естествено разпределение и произход
В природата най-разпространеният изотоп е протият — около 99.98% от водородните атоми. Деутерият е рядък, но стабилен — негова естествена изобилие е приблизително 0.015–0.016% (около 150–160 части на милион). Тритият се среща в много малки количества, образува се в горните слоеве на атмосферата при взаимодействие на космическите лъчи с азота и кислорода, и също се произвежда в ядрени реактори и водород-ядрени експерименти.
От гледна точка на космологията, количеството деутерий, създадено по време на големия взрив (Big Bang nucleosynthesis), е важен показател за плътността на барионите във Вселената — наблюденията на деутерий помагат да се проверят модели за ранната космология.
Физични и химични различия
Въпреки че химическият атом на водорода участва в същите връзки, масовите разлики между изотопите причиняват значими ефекти:
- Кинетичен изотопен ефект — химичните реакции с участието на деутерий протичат по-бавно заради по-силните и по-малко податливи на разкъсване връзки D–X спрямо H–X.
- Физични параметри — например, тежката вода (D2O) има малко по-високи точки на топене (≈3.82 °C) и кипене (≈101.4 °C) и по-висока плътност от обикновената вода (H2O).
- Спектроскопия — честотите на вибрационните и ротационните преходи се преместват, което се използва в аналитични методи и в материя-спектра за проследяване на изотопни замествания.
Приложения
Изотопите на водорода имат множество практични приложения:
- Деутерий — използва се за производство на тежка вода (D2O), която служи като модератор в някои типове ядрени реактори (например CANDU). Деутерият се използва и като маркер в химични и биологични изследвания (деутерирани съединения), в НМК (деутерирани разтворители като D2O или CDCl3 за входна честота/lock) и за стабилно изследване на механизми на реакции.
- Тритий — радиоактивен бета-емитер, използван при осветителни елементи (самосветещи знакчета), при производство на термонуклеарно гориво (D–T синтеза в изследванията за контролирана термоядрена енергия), и в радиолаборатории като източник за маркиране и следене. Тритият се произвежда промишлено в ядрени реактори и чрез реакции с литиум.
- Научни изследвания — и двата изотопа се използват в изследвания на механизми на химични реакции, в проследяване на метаболитни пътища и във физиката на плазмата и термоядрените реакции (D–T реакцията освобождава около 17.6 MeV енергия: D + T → 4He + n + 17.6 MeV).
Риск и безопасност
Тритият е бета-излъчител с ниска енергия; неговата радиация не прониква през кожата, но е опасен ако се погълне, вдиша или влезе в биологични молекули (тъй като лесно се свързва с водата и органичните вещества). Работата с тритий изисква специални предпазни мерки и контрол на изпускането, за да се предотврати замърсяване на околната среда и попадане в човешкия организъм.
Редки нестабилни изотопи (sup>4H до sup>7H)
Учени са синтезирали много краткотрайни, екстремно нестабилни изотопи на водорода като 4H, 5H, 6H и 7H в експериментални условия. Тези ядра са силно неутронно-наситени и обикновено са неустойчиви спрямо отделяне на неутрони или друг разпад — те живеят изключително кратко (често в порядъка на микросекунди до фемтосекунди в зависимост от изотопа и начина на наблюдение) и не се срещат в природата. Изследването им помага да се опознаят ядрени сили и границите на стабилността на ядрата.
Обобщение
Протият, деутерият и тритият са трите главни изотопа на водорода с важни физични, химични и приложни особености. Протият е най-разпространен и най-лек, деутерият — стабилен и полезен за промишлени и научни приложения, а тритият — радиоактивен и важен в ядрените технологии и изследванията по термоядрен синтез. По-екзотичните изотопи от 4H нагоре са предмет на фундаментални изследвания по ядрена физика.
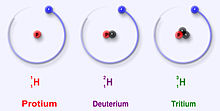
Трите най-стабилни изотопа на водорода
Протиум (водород-1)
Протият е най-разпространеният изотоп на водорода. Той съставлява повече от 99,98% от целия водород във Вселената. Наречен е протий, защото ядрото му има само един протон. Атомната маса на протия е 1,00782504(7) u. Символът на протия е 1H.Протонът на протия никога не се е разпадал при наблюдение, затова учените смятат, че протият е стабилен изотоп. Новите теории на физиката на елементарните частици предвиждат, че протонът може да се разпадне, но този разпад е много бавен. Счита се, че периодът на полуразпад на протона е 1036 години. Ако разпадът на протона е верен, тогава всички други ядра, за които се твърди, че са стабилни, всъщност са стабилни само по наблюдение, т.е. изглеждат така, сякаш са стабилни. Скорошни експерименти показаха, че ако разпадът на протона наистина се случва, то той би имал период на полуразпад 6,6 × 10 33години.
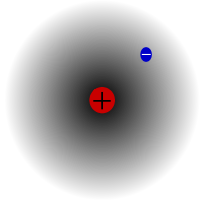
Протиум, най-разпространеният изотоп на водорода. Той е специален, защото е единственият изотоп, който няма неутрон.
Деутерий (водород-2)
Деутерият, 2H или понякога D, е друг стабилен изотоп на водорода. Този изотоп има един протон и един неутрон. Той съставлява около 0,0026 - 0,0184% от всички атоми на водорода на Земята. Деутерият е по-малко във водородния газ на Земята и е повече в морската вода (0,015% или 150 ppm). Деутерият не е радиоактивен и не вреди на живите същества. Деутерият може също да образува молекули вода. Водата, която има деутерий вместо протий, се нарича тежка вода.
Тритий (водород-3)
Тритият (3H) е най-стабилният радиоизотоп на водорода. Това означава, че от всички радиоактивни изотопи на водорода тритият е най-малко радиоактивен. В ядрото му има един протон и 2 неутрона. Тритият се разпада чрез бета минус разпад и се превръща в хелий-3. Периодът му на полуразпад е 12,32 години.Тритият се образува по естествен път при взаимодействието между газовете в горните слоеве на атмосферата и космическите лъчи. Създава се и по време на тестове на ядрени оръжия. Тритият и деутерият се използват при D-T ядрен синтез в звездите, за да отделят много енергия.
Въпроси и отговори
Въпрос: Колко основни изотопа на водорода има?
О: Съществуват три основни изотопа на водорода: протий, деутерий и тритий.
В: Стабилни изотопи ли са протият и деутерият?
О: Да, протият и деутерият са стабилни изотопи.
В: Какъв е периодът на полуразпад на трития?
О: Тритият е радиоактивен и има период на полуразпад от около 12 години.
В: Колко други изотопа на водорода са създали учените?
О: Учените са създали четири други изотопа на водорода: от 4H до 7H.
В: Съществуват ли тези четири допълнителни изотопа на водорода в природата?
О: Не, тези изотопи са много нестабилни и не съществуват в природата.
В: Какво прави основните изотопи на водорода уникални?
О: Основните изотопи на водорода са уникални, защото са единствените изотопи, които имат име.
В: Деутерият и тритият имат ли собствени символи?
О: Да, деутерият и тритият понякога получават собствени символи: Международният съюз по чиста и приложна химия обаче не харесва много тези имена, въпреки че те често се използват.
обискирам